广岛大学等的研究团队通过实验证实,给患有发育障碍的自闭症谱系障碍(ASD)小鼠施用低剂量阿片类药物,可以提高它们的社交能力。阿片类药物包括吗啡等,大剂量被用于缓解严重的癌症疼痛等。到目前为止,ASD还没有治愈的方法,但通过适当的用途转换,低剂量阿片类药物或将成为潜在的治疗方案。
广岛大学研究生院医系科学研究科(齿)细胞分子药理学的吾乡由希夫教授(中枢神经药理学)的研究团队,与制药公司开展产学合作,系统研究了阿片类药物的受体结合特性及其靶向药物的作用机制。
阿片类药物主要包括严格管控的医疗用麻醉药(如用于缓解癌性疼痛的吗啡、芬太尼、羟考酮),及精神类药物中的剧毒药品(如丁丙诺啡)。这些药物均能强力结合细胞膜上的μ型阿片受体,但丁丙诺啡激活细胞内信号转导系统的效果不如其他药物,被归类为“部分激动剂”。需特别说明的是,阿片类物质不仅包括外源性药物,也包括内源性物质,如大脑在应对危机时产生的内啡肽等。
吾乡教授长期从事ASD动物模型研究,他认为,由于ASD是由动机维持和社会交流有关的脑区功能会受到某种形式的阻碍导致,若能开发出有效作用于这些脑区的药物,则可能成为潜在治疗手段。
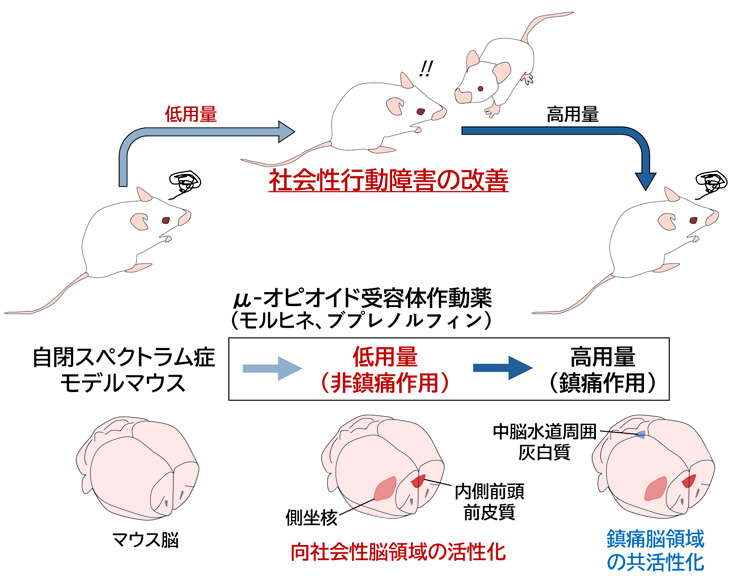
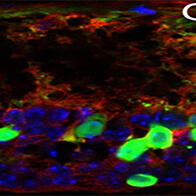
研究示意图。让自闭症谱系障碍(ASD)小鼠模型暴露于不同浓度的阿片类药物,检测其ASD症状的改善效果(供图:广岛大学)
阿片类药物因其过度使用和滥用已在多国引发严重社会问题,目前为采取措施打击成瘾现象的对象。这种阿片类药物成瘾与神经递质多巴胺的活性密切相关。它与μ阿片受体结合并激活μ阿片受体的被称为“激动剂”的化学物质(药物)大量存在,会导致多巴胺过度释放,从而形成药物依赖风险。
另一方面,如果这种激动剂以适当的剂量得到很好的调节,它就会平衡主导动机与行为驱动的多巴胺的活动。基于此药理机制,研究团队探索了是否能将其应用于改善ASD患者的核心障碍,即社交互动功能的可能性。
实验结果显示,对ASD模型小鼠注射无镇痛作用的低剂量阿片类药物时发现,能提高它们的社交技能,并使它们与其他小鼠互动。当剂量增加并开始镇痛时,这种促进社交能力的药效则会完全消失。
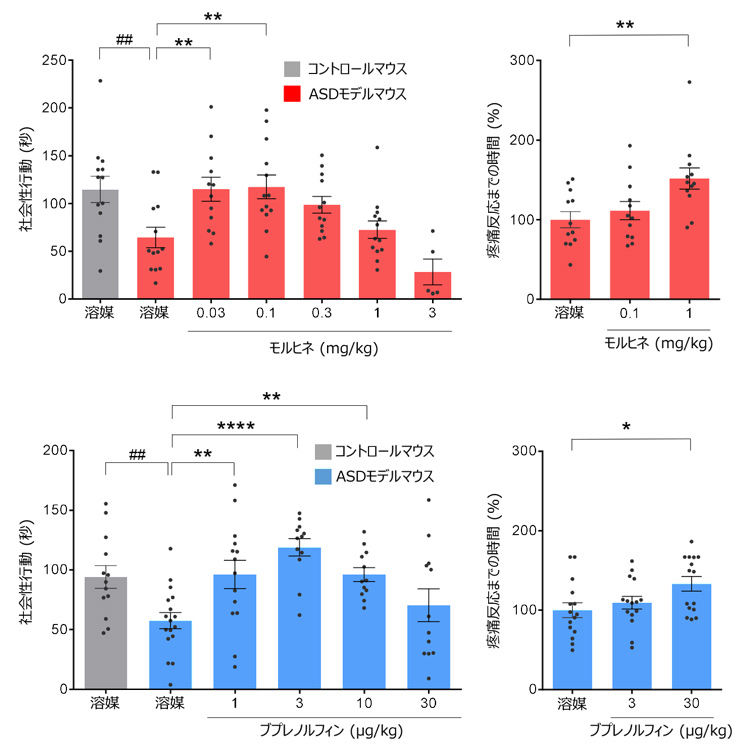
每公斤小鼠摄入0.03~0.1毫克吗啡(红色)和1~3微克丁丙诺啡(蓝色),通常可以使小鼠的社会性行为变得活跃(供图:广岛大学)
此外,研究发现,对给予阿片类药物后丁丙诺啡激活了大脑哪些区域的详细研究表明,低剂量给药时,与社会性行为相关的“内侧前额叶皮质”和“侧坐核”这两个部位被激活。
另一方面,较高剂量给药时,“中脑导水管周围灰质”和“腹侧被盖区”也被激活。中脑导水管周围灰质负责镇痛以及引发恐惧和不适,而腹侧被盖区则参与依赖性的形成。这意味着大剂量阿片类药物对ASD的治疗会适得其反。使用丁丙诺啡而非医疗用麻药吗啡的原因是,丁丙诺啡在实用化方面的导入门槛更低。
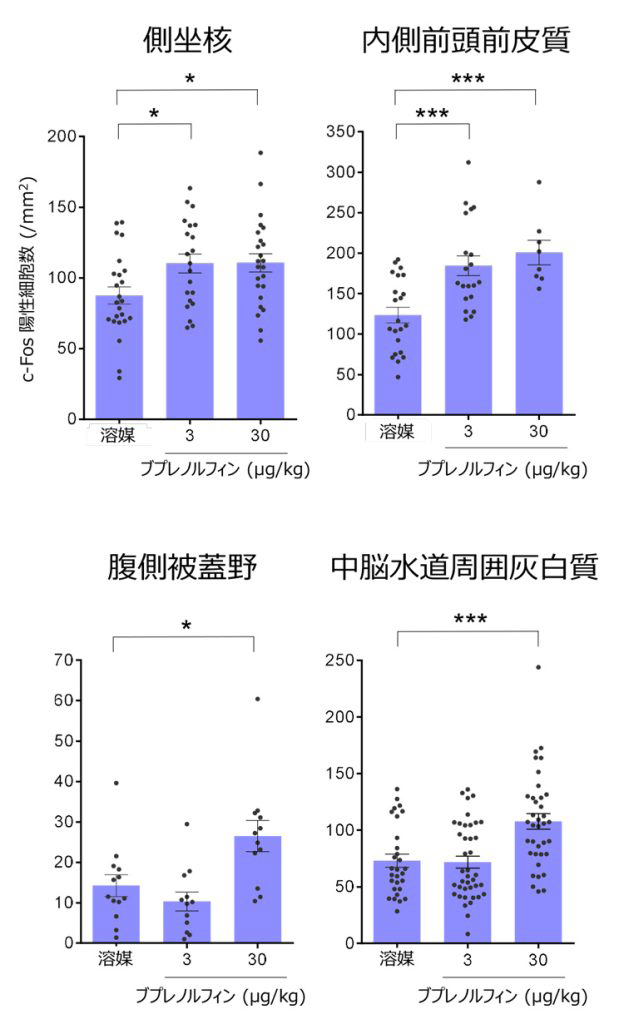
大脑不同部位对丁丙诺啡作用状态的研究结果。上图中的2个部位在低剂量下被激活,而下图中的2个部位在高剂量下被激活(根据广岛大学提供的图表重新编辑而成)
吾乡教授等表示,未来将利用病毒载体等,探究激活这些部位对治疗ASD的治疗是否重要,或者激活是否仅仅是使用药物的结果,其背后是否存在其他因素,并将详细研究这些复杂的因果关系。
将药物从最初设想的疾病治疗转向用于其他疾病治疗的方法被称为“药物再定位”。过去,花粉症药物因引起嗜睡而被用作助眠药物,安眠药沙利度胺因能抑制新生血管的形成而被用于治疗骨髓瘤。低剂量阿片类药物也有可能成为药物再定位的一个案例。
吾乡教授谈到了药物实用化之前需要解决的问题,“直接使用浓度较高的现有高剂量阿片类制剂是困难的。我们必须考虑是通过重新配制低浓度制剂来优化现有镇痛药,还是从头开始创造新的低剂量阿片类化合物”。同时,他回顾说,“低剂量阿片类药物导致的依赖性很低,这是一个从新角度出发的有趣发现”。
该研究由广岛大学、大阪大学、京都大学和盐野义制药共同开展,并得到了日本学术振兴会科学研究费助成事业、中富健康科学振兴财团、安斯泰来病态代谢研究会以及持田纪念医学药学研究财团的资助。该研究成果于2024年12月6日刊登在美国科学期刊《JCI Insight》电子版上,并于2025年2月10日由广岛大学和大阪大学联合发布新闻稿。
日文:JST Science Portal 编辑部
中文:JST客观日本编辑部
【论文信息】
期刊:JCI Insight
论文:Brain region–specific neural activation by low-dose opioid promotes social behavior
DOI:10.1172/jci.insight.182060
【相关链接】
广岛大学新闻稿 【研究成果】自闭症谱系障碍药物治疗新进展!~无镇痛小剂量阿片类药物可改善社交功能~