近年来,培养iPS细胞等干细胞并移植给人体的“再生医学”备受关注。然而,体外培养即使在相同条件下仍无法实现组织形状的均一化,尚未达到器官立体形状的准确再现地步。因此,需要明确器官形态形成的机制,并需要在试管内控制该过程。在器官形成过程中,片状上皮组织会类似折纸那样复杂折叠,形成各种器官的形态。尽管目前已知折痕具有不可逆性,但其中的机制尚未明确。
发现组织的响应会根据组织的变形时间和量而切换
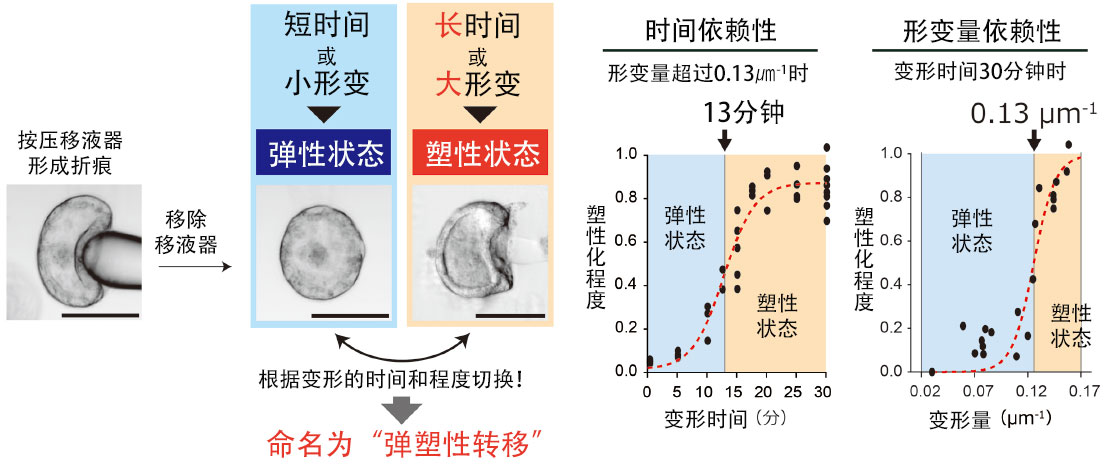
给组织施加外力时发生变形,撤力后恢复原状的特性称为“弹性”;撤力后不恢复原状的特性称为“塑性”,兼具这两种特性的称为“弹塑性”。研究团队通过实验揭示了折痕对时间与形变量的依赖性。
金泽大学纳米生命科学研究所奥田觉副教授的研究团队,开发出了可对活体上皮细胞片施加复杂三维变形的新技术,并将其应用于脊椎动物眼原基的眼杯类器官和小鼠胚胎的眼组织。研究发现上皮细胞片折痕的不可逆性会随着施加变形的“时间”与“形变量”发生改变,并将这一现象命名为“弹塑性转移”。具体而言,当施加形变超过13分钟,表征曲率变化的形变量超过0.13微米(1微米=百万分之一米)时,折痕将固定并无法复原。
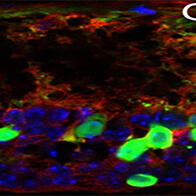
为探究这种变化在阈值附近呈现阶跃式变化的原因,研究团队关注了与细胞形态维持及形变相关的肌动蛋白分子。通过可直接观察活体组织的荧光实时成像技术发现,肌动蛋白分子在折痕内侧聚集,形成了类似L型金属件的“肌动蛋白支架”结构。
本次研究发现:细胞通过感知上皮细胞片所受形变的时间与量形成肌动蛋白支架,进而控制折痕的不可逆性。这一发现解答了“为何器官形状一旦形成便不可逆”这一发育生物学中的根本性疑问,并有助于为组织工程和再生医学领域的技术创新做出贡献。(TEXT:JST广报课中岛彩乃)
原文:JSTnews 2025年3月号
翻译:JST客观日本编辑部