长崎大学热带医学研究所分子感染动力学解析领域的稻冈健Daniel教授、爱媛大学蛋白质科学中心的福本隼平特定研究员、群马大学研究生院保健学研究科的德舛富由树教授的研究团队,与日本国立国际医疗研究中心研究所、自治医科大学合作,于2月14日发表研究成果称,发现了疟原虫生存所必需的脂质合成酶——酰基转移酶(PfLPLAT1)。当破坏该酶的基因后,疟原虫就会迅速死亡。该成果有望为开发新的抗疟疾药物做出贡献。相关成果已发表在国际学术期刊《Communications Biology》的1月29日刊上。
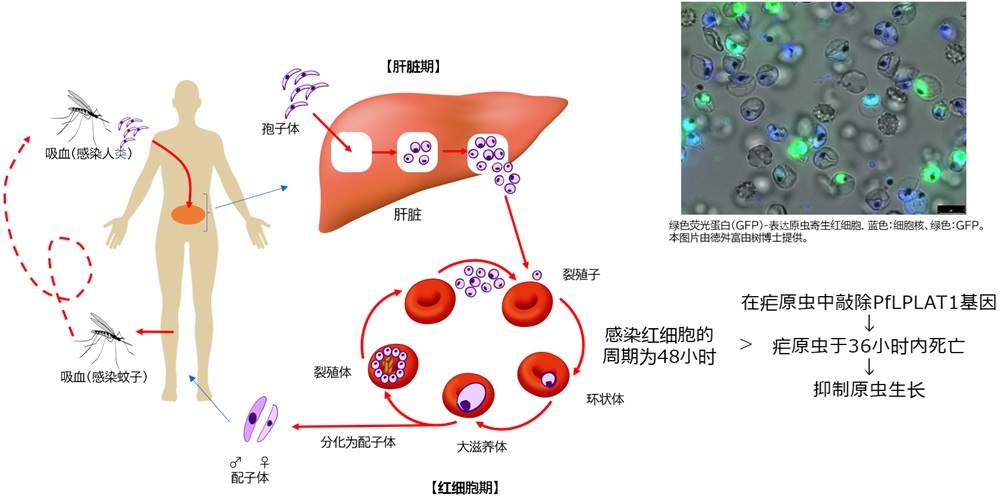
图1:疟原虫的生物周期和酰基转移酶(PfLPLAT1)基因受破坏株影响的效果。本图修改自 “Development of Medicines for Infectious Diseases-Malaria”, K. Kita, Yakugakuzasshi, 140(7): 888, (S. Matsui 和 J. Hong)(供图:长崎大学)
疟疾是世界三大传染病之一,每年约有2.6亿人感染并造成60万人死亡,主要流行于非洲和东南亚地区。引发疟疾的疟原虫通过蚊虫叮咬进入人体,首先在肝脏中增殖,然后侵入红细胞并增殖,继而引发高热、贫血等症状。恶性疟原虫感染更可能导致脑损伤、酸中毒(血液过度酸化)及重症贫血等致命风险。
现在虽有疫苗,但效果有限且难以普及,目前主要采用被称为特效药的青蒿素复方疗法。然而,已有报告称出现了青蒿素耐药性疟原虫。
此次,研究团队重点关注了构成恶性疟原虫细胞膜的脂质的合成途径。疟原虫在分裂、增殖时会合成大量脂质,但对这一途径的研究长期滞后,对该途径内的酶群也了解甚少。
研究人员在磷脂质合成途径中,针对在仅含单一酰基链(磷脂分子中的脂肪酸衍生双碳链)的磷脂质上再添加一条酰基链并转化为常规磷脂质的“溶血磷脂酰基转移酶”进行了鉴定与功能分析。此前有报道称这种酶在细胞水平上具有活性,但酶本身的功能从未得到证实。
因此,研究团队从基因数据库中筛选出与人类酶相似的功能未知的基因(PfLPLAT1),制作出能够进行条件特异性基因破坏的基因改造疟原虫,并对该酶的功能进行了分析。
结果显示,当该基因遭破坏时,疟原虫在大约36小时内死亡,比其感染红细胞的48小时周期还要短。另一方面,在破坏基因的同时强制表达PfLPLAT1时,疟原虫就不会死亡,这表明PfLPLAT1酶对疟原虫的生存不可或缺。在濒死的疟原虫细胞中,观察到了明显的结构缺陷。
对酶活性进行研究后发现,这种酶具有将多种溶血磷脂转化为二酰基体的功能,并且明确了它是维持生物膜中多种分子构成比例的分子。
脂质合成途径不仅涉及细胞内的代谢,还能生产构成细胞膜的分子,因此有望为同时破坏代谢和结构的药物开发带来新的突破。
稻冈教授表示:“此次研究最大的突破在于证实PfLPLAT基因对疟原虫的生存不可或缺。由于该基因不可或缺,使用常规的基因破坏方法无法获得存活的疟原虫,最终通过添加雷帕霉素建立基因破坏系统才得以解析,此过程最为艰辛。论文的责任作者德舛博士(群马大学)是疟原虫脂质代谢领域的权威专家。期待未来开发以PfLPLAT为靶点的新药,并进一步明确PfLPLAT在疟原虫的生物周期以及对宿主环境的适应等生命现象中如何发挥作用。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Communications Biology
论文:Pivotal roles of Plasmodium falciparum lysophospholipid acyltransferase 1 in cell cycle progression and cytostome internalization
DOI:10.1038/s42003-025-07564-4