岐阜大学研究生院医学系研究科的横山达彦助教、久堀智子副教授、永井宏树教授,以及京都大学医生物学研究所的秋山芳展教授等人的研究团队,与奈良先端科学技术大学院大学及国立研究开发法人理化学研究所联合研究发现,细菌利用分子马达产生的机械力感知铁的存在,并将铁摄入细胞内。相关研究成果已发表在期刊《PNAS》的在线版上。
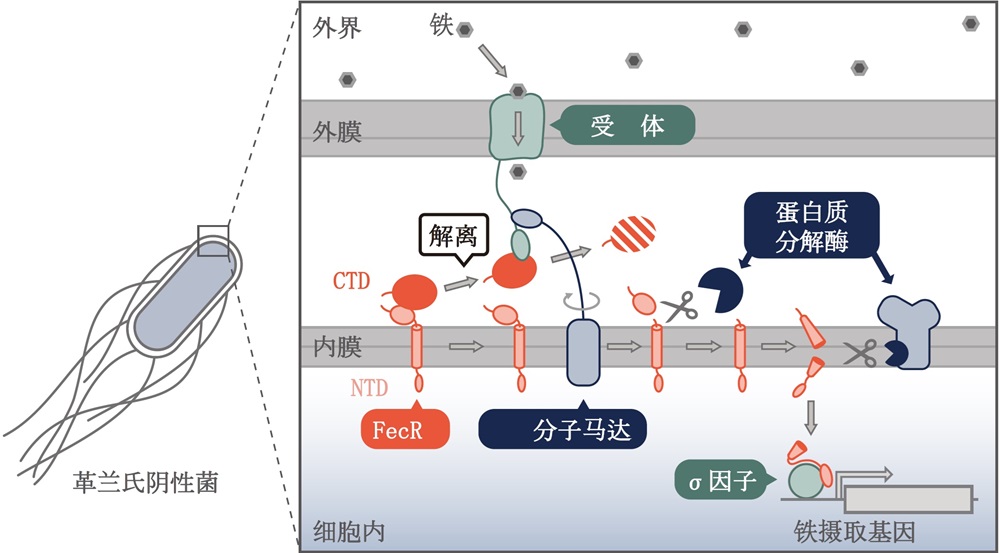
图1革兰氏阴性菌感知外界存在铁的机制(供图:岐阜大学)
革兰氏阴性菌通过外膜和内膜与外界隔开。细菌内膜中存在分子马达,利用质子驱动力产生机械力。运用这一机械力,存在于外膜上的受体蛋白将捕获的外界铁摄入细胞内。尽管这类将铁摄入细胞内的机制已取得研究进展,但如何感知外界存在的铁、并将信息传递至细胞内,诱导铁摄取基因表达的机制仍未被阐明。
研究团队发现,分子马达产生的机械力也会传递给内膜中的膜蛋白FecR。FecR以NTD结构域和CTD结构域两个结构域分离的状态插入内膜。分子马达产生的机械力通过受体蛋白传递至FecR的CTD结构域,这导致CTD结构域从NTD结构域解离。当CTD结构域解离后,NTD结构域会被蛋白质分解酶连续切割两次。最终,自NTD产生的小片段从膜转移至细胞内,通过激活σ因子,诱导构成铁摄取系统的基因表达,使细菌能够更高效地摄取外界的铁。
本次研究揭示了膜蛋白在严格调控下连续切割以实现细胞外信息向细胞内传递的分子机制。蛋白切割介导的信息传递不仅存在于细菌中,也见于包括人类在内的多种生物,参与细胞死亡、胆固醇合成、神经退行性疾病发病等对生命至关重要的现象。本次研究不仅解明了一种伴随蛋白切割的新型信息传递机制,还部分揭示了形成生物体功能调控基础的机制。
横山助教表示:“本研究研究的信息传递系统的存在已为人所知近半个世纪。然而,作为该系统核心的FecR传递信息的分子机制却一直笼罩在谜团中。本研究通过精细的生物化学分析,解析了FecR在细胞内合成、插入膜并最终降解的过程,也即所谓的FecR蛋白的‘一生’,揭示了信息传递机制的全貌。我们相信,本研究将成为今后推进类似类型信息传递机制研究的不可或缺的基石。最后,我们要向一直以来推动了众多作为本研究基础的研究,并向为本研究领域发展做出巨大贡献的马克斯·普朗克生物学研究所的Volkmar Braun博士表示由衷的敬意。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Proceedings of the National Academy of Sciences of the United
States of America
论文:Cleavage cascade of the sigma regulator FecR orchestrates
TonB-dependent signal transduction
DOI:10.1073/pnas.2500366122