顺天堂大学医学部耳鼻咽喉科讲座的神谷和作副教授与宇梶太雄兼职助教、东京大学研究生院理学系研究科的濡木理教授等人的研究团队发表研究成果称,成功开发出了可根治显性遗传型耳聋的基因组编辑技术。通过将腺相关病毒载体与基因组编辑技术相结合,成功将比既往更大尺寸的基因输送到内耳细胞中。在小鼠实验中确认,可使耳聋的内耳异常间隙连接蛋白恢复正常功能。预计5到6年后将启动临床试验。该成果有望成为遗传型耳聋的根治性疗法。相关成果已发表在国际学术期刊《JCI Insight》的月10日刊上。
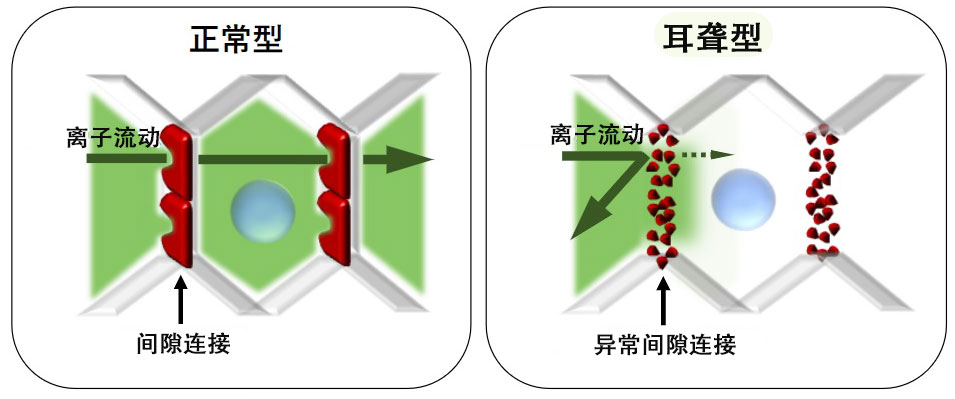
图1 GJB2基因变异型耳聋病理机制
通常通过间隙连接可维持内耳的离子浓度恒定,但遗传性耳聋患者由于GJB2基因变异产生的异常间隙连接,使得离子浓度无法再保持恒定。由此,导致离子环境稳态失衡进而引发耳聋。(供图:顺天堂大学)
与遗传性耳聋相关的基因有130种以上,其中约48%由GJB2基因变异引起。该基因是构成内耳“间隙连接”的蛋白质,正常的间隙连接可以使内耳的离子浓度保持恒定,从而保障听觉功能正常运作。而变异蛋白质会导致离子环境的稳态遭到破坏,从而引发耳聋。
迄今为止顺天堂大学的研究团队已经明确了由该基因变异导致出现异常间隙连接而引发耳聋的机制,并成功通过向耳聋模型小鼠补充GJB2基因,使其听力得以恢复。
而在显性遗传类型的变异中,由于变异产生的异常蛋白质会阻碍内耳功能,因此仅导入正常基因无法恢复功能。针对这种情况的治疗,需要能够正常改写变异部分的基因组编辑技术、以及能够递送该基因的载体。作为传统载体使用的腺相关病毒载体(AVV)能够运载的基因上限约为4.7Kbp,而用于基因组编辑的基因组尺寸更大。而且,能够进行编辑的基因位点也存在限制。
为此,研究团队此次采用了独特的基因递送技术和基因组编辑技术——顺天堂大学开发了能够递送该基因的病毒载体AVV“AVV-Sia6a”,东京大学则开发了搭载基因尺寸小、靶向范围广的新型基因组编辑技术“SaCas-NNGABE”的内耳基因组编辑载体。据悉,这两项技术均已申请专利。
研究人员使用这种病毒载体,对显性遗传型GJB2基因变异型耳聋模型小鼠和模型细胞进行了基因组编辑治疗。
结果显示,单次给药就能高效地修复目标基因变异。在模型小鼠和模型细胞中均观察到正常间隙连接蛋白的结构体,证实了其正常的物质运输能力已得到恢复。在模型细胞中,编码GJB2基因中精氨酸的序列C转变为T会引发耳聋,而给药后也确认到约50%的T已修复为正常的C。
神谷副教授表示:“应用该技术能够针对此前未曾成为基因治疗开发对象的、尺寸较大的耳聋基因以及各种变异类型进行治疗,推动耳聋治疗技术的飞跃发展。目前,我们正从患者那里获取细胞并制备iPS细胞,首先计划利用这些细胞来评估治疗效果。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:JCI insight
论文:AAV-mediated base editing restores cochlear gap junction in GJB2 dominant-negative mutation-associated syndromic hearing loss model
DOI:doi.org/10.1172/jci.insight.185193