日本的理化学研究所生命功能科学研究中心合成生物学研究团队负责人上田泰己、副研究员(研究当时)秋山郁人以及客座研究员松本桂彦等人组成的合作研究团队开发出了一种高通量和简单的使小鼠整个器官透明化、染色、3D成像和数据分析的方法。该方法有望加速从既往利用组织切片进行2D观察向针对整个器官的3D生物学过渡,并为下一代药物开发研究和病理诊断技术做出贡献。研究成果已发表在《Nature Protocols》上。
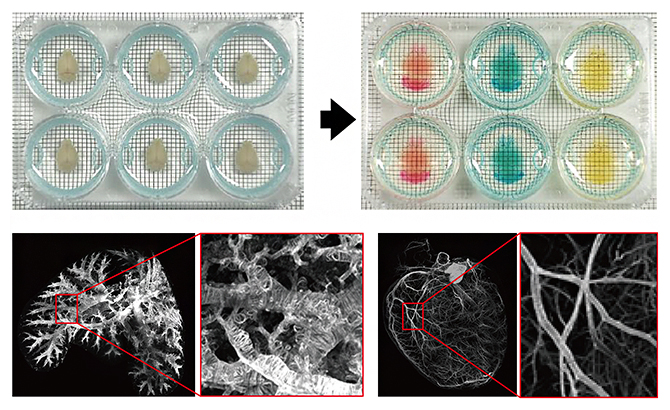
图1使用6孔板的小鼠器官透明化处理(供图:理化学研究所)
上图为使用6孔板对小鼠大脑进行透明化和染色的示例。用固定液(多聚甲醛)处理的不透明器官被透明化并进行核染色。颜色差异是由于用于核染色的3种试剂(PI、SYTOX-G和RD2)造成的。背景方格为2mm。
下图为使用光片显微镜在低倍/宽视场下观察透明化的肺(左)和心脏(右)的整体图像,以及在高倍下观察各自红框区域的图像。
用于对生物体内部结构进行光学观测的组织透明化技术早在1900年左右就已问世,在过去十几年间,该技术与光片显微镜的结合取得了长足进步。透明化技术主要有使用有机溶剂、使用水溶性化合物和凝胶包埋3种。
团队负责人上田等开发出一种使用与荧光蛋白和免疫染色等兼容的水溶性化合物的透明化技术CUBIC,还开发了染色、成像和分析技术。单项元素技术的性能达到了世界最高水平,但要在基础研究和临床实践中广泛使用,还需要进一步简化方案(protocol)、建立数据分析流水线(pipeline)。
此次,研究团队开发了一个简单且可并行处理的透明方案。迄今为止,因为每个样品都必须放在1个试管中,澄清和清洗溶液总共要更换近20次,当样品数量较多时,溶液更换非常耗时,所以CUBIC一直难以用于大规模研究。因此,将3D打印的透明插入装置插入细胞培养常用的6孔培养板中,每个培养板可同时处理6个样品,每个样品的溶液更换速度可提高4~5倍。此外,由客座研究员松本等开发的低倍率/宽视场高速光片显微镜可快速生成小鼠的大脑、肺部、心脏和肾脏等整个器官的3D荧光图像。通过增加脱色过程,该方案还能使眼球等高色素组织变得透明。
此外,研究人员还创建了一个从光片显微镜获得的3D图像中检测细胞的程序,并将其转换为适用于基于云平台、可对整个小鼠大脑进行定量分析的CUBIC-Cloud格式。作为实施该流水线的一个示例,研究人员尝试对服用了中枢神经系统药物的小鼠大脑进行了切除、透明化、免疫染色、成像、细胞检测和定量分析,通过可视化掌握了药物对整个大脑的影响。
免疫染色使用了神经活动标记物c-Fos的抗体。通过检测c-Fos阳性细胞并在CUBIC-Cloud上对其进行分析,可以分析出整个小鼠大脑中哪些神经元被激活,以及哪些区域因小鼠是否接受药物治疗而存在差异。分析结果表明,从透明化到分析的流水线可评估药物对中枢神经系统的影响。
在这一演示实验中,研究人员对药物诱导神经活动进行了全面的定量分析,该方法也可应用于可视化和定量评估抗体和核酸药物在器官中的输送位置以及积聚位置等。此外,由于透明化技术可以观察到组织和器官中的所有细胞,因此即使是转移性癌细胞和干细胞等极少数组织中存在的细胞,也能被观测和量化,而不会遗漏。
从利用组织切片的2D生物学转向利用整个器官的3D生物学,有望提高包括药物发现和临床研究在内的各个领域的研究效率。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Protocols
论文:A multiwell plate approach to increase the sample throughput during tissue clearing
DOI:10.1038/s41596-024-01080-1













