阿尔茨海默病的原因之一是脑内异常积聚的β-淀粉样蛋白(Aβ)。Aβ堆积后形成被称为“纤维”的团块,会对神经细胞造成不良影响。尽管阻止Aβ纤维生长被认为是治疗阿尔茨海默病的关键,但其生长过程和停止机制此前并未被详细解析。
图1 研究示意图(供图:自然科学研究机构生命创成探究中心/分子科学研究所,Copyright © 2024 The Authors)
日本自然科学研究机构生命创成探究中心与分子科学研究所的加藤晃一教授(名古屋市立大学研究生院药学研究科教授)、名古屋大学研究生院理学研究科的内桥贵之教授以及筑波大学精密医学开发研究中心的研究团队,利用作为最先进技术的高速原子力显微镜(HS-AFM),对Aβ纤维生长过程进行了分子水平的实时观察。观察的结果表明,一条Aβ纤维由两条初纤维(protofilament)构成,通过Aβ分子交替结合方式使纤维延伸。
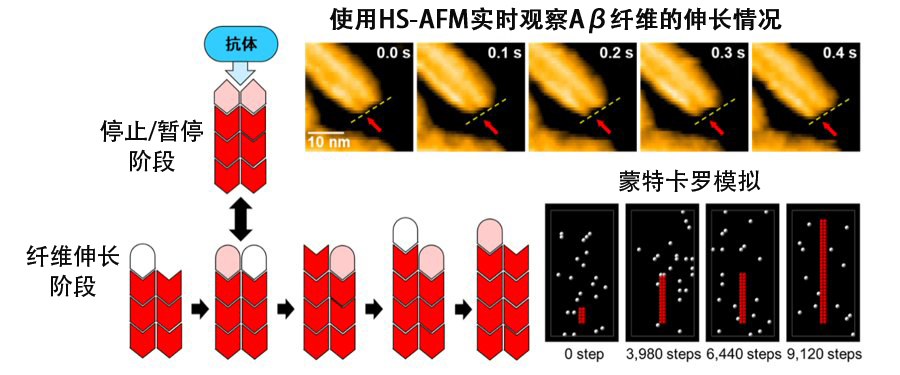
图2 结合高速原子力显微镜(HS-AFM)和蒙特卡罗模拟,研究人员捕捉到了β-淀粉样蛋白(Aβ)纤维交替延伸与停止的情况。揭示了4396C抗体选择性结合纤维生长的“停止状态”并有效抑制Aβ纤维进一步生长的机制。(供图:自然科学研究机构生命创成探究中心/分子科学研究所,Copyright © 2024 The Authors)
研究还进一步发现,当两条初纤维的末端处于对齐状态时,纤维的生长会暂停并会频繁进入一种“停止状态”。这种停止状态是Aβ纤维生长过程中自然出现的重要步骤。
研究还发现,一种名为“4396C”的特异性抗体会选择性结合处于“停止状态”的纤维末端,有效阻止纤维的进一步延伸。这一发现揭示了Aβ纤维生长完全停止,进展受到抑制的机制。
这项研究阐明了Aβ纤维的生长会重复交替延伸与停止的独特机制。它解明了参与阿尔茨海默病进展的新要素,为开发针对Aβ纤维“停止状态”的新治疗方法提供了可能性。
未来,研究团队计划通过进一步解析4396C抗体的作用机制,以实现抑制Aβ纤维生长的新型疗法。此外,研究团队还计划以此次成果为基础开展进一步的研究,旨在将该技术应用于其他淀粉样蛋白相关疾病。
相关研究成果已在线发表于期刊《Journal of the American Chemical Society》上。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Journal of the American Chemical Society
论文:Single-molecule kinetic observation of antibody interactions with growing amyloid β fibrils
DOI:doi.org/10.1021/jacs.4c08841