由日本理化学研究所脑神经科学研究中心团队负责人西道隆臣和长崎大学研究生院医齿药学综合研究科教授岩田修永等组成的国际联合研究团队宣布,明确了阿尔茨海默病患者大脑中β-淀粉样蛋白(Aβ)转变为难以降解的有害物的生成机制。研究人员对经人为操作使中性内肽酶(降解Aβ的酶)失活的阿尔茨海默病小鼠模型进行分析,结果发现在该小鼠体内,通常不发挥作用的其他酶开始分解Aβ,而在此过程中,Aβ会被添加一种阻碍分解的修饰,从而导致有害Aβ不断积累。这一发现有望推动新型治疗药物的开发。相关研究成果已于9月30日发表在国际学术期刊《Life Science Alliance》上。
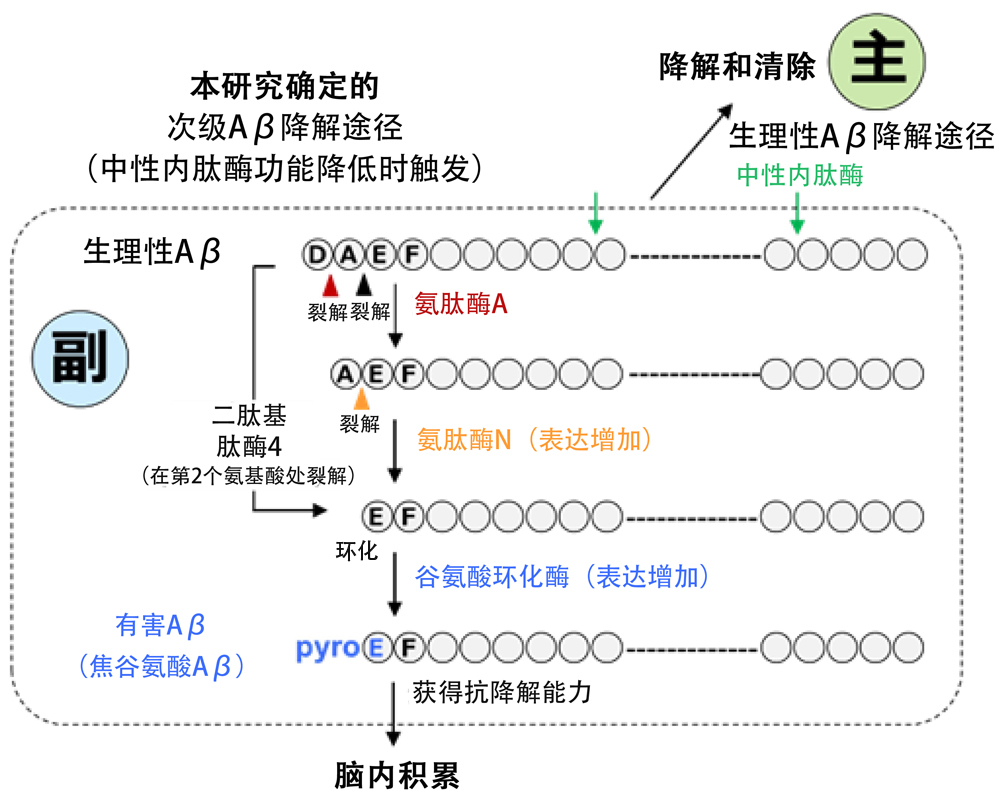
图 有害Aβ的生成机制(供图:理化学研究所)
阿尔茨海默病(AD)患者大脑中积累并形成淀粉样蛋白斑块的Aβ大部分是被称为 “PyrogluAβ”的有害Aβ,其自聚集能力较正常生理性Aβ高出250倍左右,且在结构上与正常大脑中产生的生理性Aβ存在差异。研究人员发现,生理性Aβ会被中性内肽酶降解和清除,但AD患者大脑生成中性内肽酶的能力严重减弱。
研究人员发现,大脑中的Aβ会反复生成和降解,并随着时间推移在大脑中逐渐积累,直至患上AD,在此期间,氨基末端结构会受到各种修饰。
由于“PyrogluAβ”具有高聚集性,所以针对Aβ积累量等进行的定量分析此前一直未取得深入进展。此外,从生理性Aβ转变为有害Aβ的机制也并不明确。
在本研究中,为区分大脑中一定量存在的Aβ,研究团队通过化学合成了用放射性同位素标记的具有多种氨基酸末端结构的Aβ,之后将其注射到大鼠的海马区域中,并分析了降解速率。
结果表明,生理性Aβ和仅去除氨基酸末端氨基酸的Aβ降解迅速,而去除氨基酸末端且具有环状结构的“PyrogluAβ”降解极为缓慢。使用特异性抗体对AD患者脑样本中多种Aβ的丰度进行定量分析后发现,“PyrogluAβ”占总量的40%以上,而生理性Aβ的含量还不到5%。
在对传统AD模型小鼠和经基因工程改造使中性内肽酶失活的新一代AD模型小鼠进行的分析中,AD模型小鼠脑中与生理性Aβ具有相同氨基酸末端结构的Aβ含量在12月龄前高于中性内肽酶正常工作的模型小鼠,之后差异缩小。在中性内肽酶失活的模型小鼠脑中,“PyrogluAβ”的积累与月龄有关,在24月龄时达到2.5倍。
此外,研究人员利用迄今为止尚未实现的质谱分析法设计了一种检测“PyrogluAβ”的预处理方法,通过利用匹兹堡化合物B(PiB)作为成像探针,成功通过PET捕捉到脑内“PyrogluAβ”增加的情况。
研究表明,“PyrogluAβ”会裂解生理性Aβ氨基酸末端的2个氨基酸,其中第3个谷氨酸会形成环状结构。在此之前,研究团队负责人西道已证明,“PyrogluAβ”的生成涉及外肽酶(如氨肽酶和二肽基肽酶),这些酶能够肽的氨基末端裂解氨基酸。
为此,研究人员研究了外肽酶在中性内肽酶失活的情况下补偿Aβ降解的可能性。研究人员重点研究了氨肽酶、二肽基肽酶和谷氨酸环化酶在Aβ降解中的潜在作用,发现当与Aβ发生反应时,这些酶均具有足够的裂解活性。研究还发现,在中性内肽酶失活的AD小鼠模型中,脑内氨肽酶和二肽基肽酶的表达水平随着年龄增长而增加。
这些酶具有裂解活性,但在降解过程中,抵制降解的“装饰性”谷氨酸环化酶会附着在Aβ上,从而阻止降解,导致有害Aβ逐渐积累。
与可靶向清除已在大脑中积累的“PyrogluAβ”的药物多奈单抗(Donanemab)不同,研究显示,通过抑制“PyrogluAβ”生成有害转化的外肽酶(氨肽酶和二肽基肽酶)以及焦谷氨酰环化酶,有望在“PyrogluAβ”形成前阻止其的积累。
研究团队负责人西道表示:“目前,获得美国FDA、日本厚生劳动省等批准的用于阿尔茨海默病治疗的抗体药物有两种:仑卡奈单抗和多奈单抗(Lecanemab和Donanemab)。后者可识别西道(理化学研究所)和井原(东京大学)于1995年发现的Pyroglutamic Aβ,前者是一种由兰费尔特(Lars Lannfelt,瑞典乌普萨拉大学)等开发的可识别可溶性Aβ寡聚体的抗体。由于这些抗体具有不同的表位(抗体在分子水平上识别的位点),因此同时使用可能会产生叠加效应。但需注意脑出血等副作用”。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Life Science Alliance
论文:Metabolic resistance of Aβ3pE-42, a target epitope of the anti-Alzheimer therapeutic antibody, donanemab
DOI:10.26508/lsa.202402650













