日本医药基础・健康・营养研究所(NIBIOHN)新药研发设计研究中心副主任足立淳等人的研究团队与国立癌症研究中心及京都大学合作,通过高精度磷酸化信号解析技术明确了新的胃癌治疗靶点。研究团队此次开发出了一种能够评估患者个体的磷酸化信号特性的技术,并明这种确特性可分为三种亚型,成功发现了新的治疗靶点。该研究成果将有望促进开发治疗方法。相关成果已于10月1日发表在国际学术期刊《Cell Reports》上。
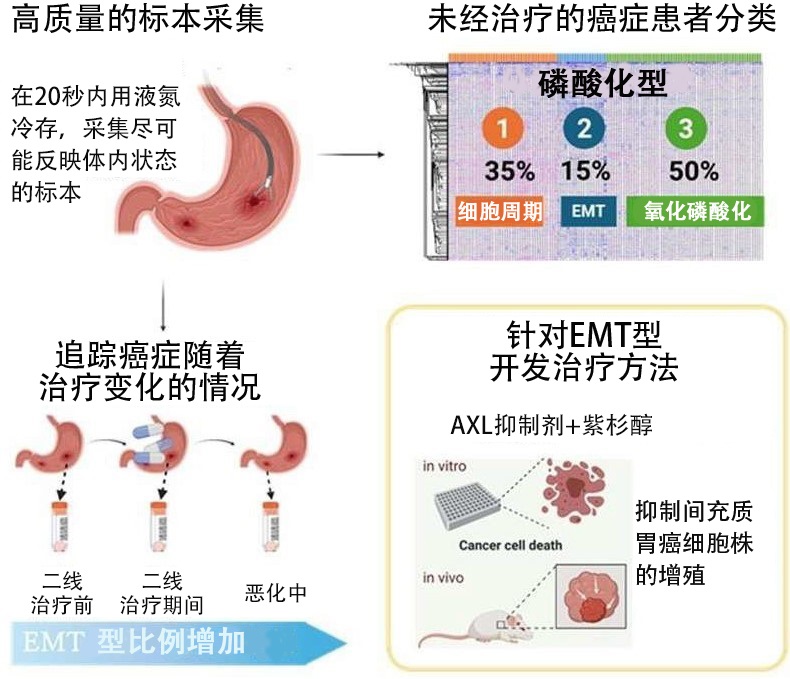
图1 从使用内窥镜活检标本的磷酸化信号解析到开发治疗方法的研究概要(供图:医药基础・健康・营养研究所)
胃癌的患病人数和死亡人数在癌症中居第三位,尤其是不能切除的晚期胃癌的预后效果非常差,中位生存期约为12个月。适用于晚期胃癌的有效分子靶向药物目前还十分有限。
由于用作抗癌药的分子靶向药物大多直接作用于蛋白质,癌细胞内部所有蛋白质(蛋白质组)整体的信息有望对治疗方法的选择发挥作用。鉴于通过磷酸化修饰的磷酸化信号能够对癌细胞的多种功能加以控制,所以人们希望这种解析能够应用于“癌症精准医疗”中。
此前,研究团队已经开发出了一种利用内镜检查中采集并立即冷冻的微量活检标本来解析磷酸化信号的技术,并报告了患者在接受曲妥珠单抗(Trastuzumab)治疗前后的应答率存在的差异。
在本次研究中,研究团队改进了此前的信号分析方法,对未经治疗的胃癌患者的127个标本进行了磷酸化信号解析。
解析结果显示,每个标本平均有2万1103个磷酸化位点被成功量化,其中的35%被归类为亚型1“细胞周期调控激酶群被激活型”,15%被归类为亚型2“上皮-间质转换(EMT)型”,50%被归类为亚型3“氧化磷酸化亢进型”。
研究团队以9名无法切除的晚期癌症患者为对象,对其一线治疗(化疗)后、二线治疗期间和恶化中的磷酸化信号进行了解析,结果发现,亚型2会随着治疗的进行而增加,转变为对药物反应较差的高恶性程度。
目前已知,构成亚型2的间充质癌细胞对化疗、分子靶向治疗、免疫治疗有耐受性且容易转移,所以预后不良。
为此,研究团队着眼于亚型2中已被激活的受体型酪氨酸激酶“AXL”,并在培养胃癌培养细胞时将两种AXL抑制剂分别添加到紫杉醇中,观察其增殖抑制效果。结果发现,仅在AXL活性较高的间充质胃癌培养细胞中确认到了AXL抑制剂的增效作用。
此外,在移植了间充质胃癌培养细胞形成肿瘤的小鼠实验中,通过联合使用AXL抑制剂和紫杉醇,发现也抑制了肿瘤细胞的增殖。
上述技术的重要性在于,能够在治疗前和治疗期间的进行动态解析,可用于追踪患者个体的癌症对药物产生的变化,能够确定作为靶点的酪氨酸激酶等物质。
足立副中心主任表示:“我们花了大约6年时间开发出了精确监测人体内磷酸化信号的技术。此次以胃癌为对象进行了研究,揭示了癌症的状态会随着治疗的进行而产生动态变化,这将有助于开发新的治疗方法。今后我们计划继续推进研究,并将对象扩展至胃癌以外的癌症。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Cell Reports
论文:Phosphoproteomic subtyping of gastric cancer reveals dynamic transformation with chemotherapy and guides targeted cancer treatment
DOI: doi.org/10.1016/j.celrep.2024.114774













