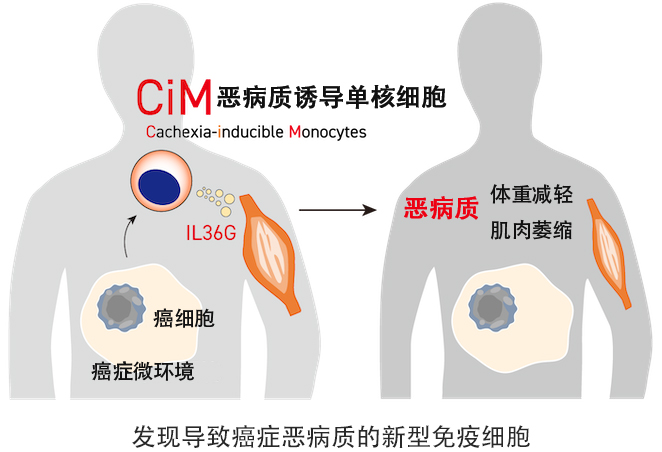
癌症患者通常伴随着消瘦,这种现象被称为恶病质,病状表现为全身炎症伴随肌肉减少,大多数癌症晚期患者都会出现这种情况。但其发病机制尚未被充分研究。东京药科大学生命科学部的原田浩德教授、立命馆大学药学部的林嘉宏教授等组成的研究团队,首次在全球范围内确认到随着癌症进展,出现了在正常情况下无法观察到的特殊单核细胞(白血球的一种),这种细胞分泌一种名为IL36G的细胞因子,能够导致肌肉减少。研究人员将其命名为Cachexia-inducible Monocyte(CiM,恶病质诱导单核细胞)。研究发现,抑制IL36G的作用,在多种类型的晚期癌症小鼠中,恶病质的发生得到了抑制,这为开发针对癌症恶病质的有效新疗法带来了希望。相关研究成果已发表在《Nature Communications》上。
癌症恶病质被定义为“无法通过正常的营养供应来完全恢复,导致进行性功能障碍,并以骨骼肌量持续减少为特征的多因素性综合征”。 恶病质存在于80%的晚期癌症患者中,不仅导致治疗效果减弱和生活质量(QOL)下降,还是约30%癌症患者的死亡原因。
研究团队重点研究了慢性粒单核细胞白血病(CMML)。CMML是一种单核细胞持续增生的血液癌,在CMML患者中经常出现体重减轻、肌肉萎缩等恶病质症状。这种恶病质症状在其他血癌中并不常见。因此研究人员推测,CMML患者体内可能存在某种特殊的单核细胞群体,是恶病质的原因。
为了验证这一假设,研究团队创建并详细分析了CMML模型小鼠。使用从CMML患者中发现的NUP98-HBO1融合基因创建的模型小鼠与CMML患者的情况相似,都出现了单核细胞增加,体重减轻的现象。对这些小鼠进行详细调查后发现,与健康小鼠相比,这些小鼠的肌肉萎缩和肌肉力量下降程度更显著。
研究人员从该模型小鼠体内提取了单核细胞,并与小鼠的肌肉纤维细胞(C2C12细胞)一起培养,结果观察到肌肉纤维萎缩。这一结果表明,在CMML小鼠体内增加的单核细胞中,存在具有减少肌肉功能的特殊细胞。
研究人员通过RNA测序分析了单核细胞内所有基因的表达水平,确定了仅在体重减轻的CMML小鼠的单核细胞中表达水平才会上升的几个基因。并通过流式细胞术验证了这些基因是否在单核细胞中表达为蛋白质。
由此,研究人员在患有恶病质的CMML小鼠的单核细胞中,发现存在一个特殊的细胞群体,这些细胞表达健康小鼠单核细胞中不存在的CD38抗原,并分泌引起肌肉萎缩的细胞因子IL36G。
为了进一步了解CiM的特征,研究人员进行了单细胞RNA测序分析。结果发现CiM是具有与嗜中性核粒细胞相似性质的特殊单核细胞。此外,研究还表明,CiM在体重下降开始前就已经出现,而CiM的诱导与TLR4(Toll样受体4)的刺激密切相关。
已有报告显示,在进展性癌症晚期患者血液中HMGB1和S100A9等蛋白质水平上升。由于已知这些蛋白质会刺激TLR4,可能参与了CiM的诱导。单核细胞数量的增加不仅在血液癌症患者中被观察到,在各种实体癌症患者中也被报告与较差的预后相关。
为此,研究人员对乳腺癌和皮肤癌的小鼠模型进行了分析,结果发现CiM会随着癌症的恶化而出现,并导致恶病质。进一步分析大肠癌和肾癌患者的单核细胞的基因表达数据后证实,CiM随着癌症的进展而出现。这些结果表明,引起肌肉萎缩的CiM的出现与癌症类型无关,且在癌症恶液质中具有普遍性。
研究人员在癌症晚期小鼠身上,通过抑制单核细胞的IL36G的产生或阻断肌肉的IL36受体,验证了CiM和IL36G是否能成为恶病质的治疗靶点。结果证实,通过阻断CiM相关的IL36G的功能,可以控制恶病质的发病。
目前,尚无能够显著改善癌症恶液质中肌肉减少的治疗方法。此次的发现,对于开发癌症恶病质的新疗法奠定了重要的基础。由于针对IL36受体和CD38的抗体药物已经被用于治疗炎症性疾病和血癌,今后,通过药物重新定位,如果能将这些已在人体中证实安全和得到动态确认的药物应用于癌症恶病质的治疗,那么开发新疗法所需的时间和成本将可能会大幅减少。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Nature Communications
论文:IL36G-producing neutrophil-like monocytes promote cachexia in cancer
URL:https://www.nature.com/articles/s41467-024-51873-x













