学习院大学理学部生命科学科的添田义行助教、小池力(博士生)、高岛明彦教授、椎叶一心助教、东京大学研究生院理学系研究科的吉村英哲助教、早稻田大学理工学术院的坂内博子教授等人组成的研究团队发表研究成果称,搞清楚了包括阿尔茨海默病在内的被统称为“Tau蛋白病(tauopathy)”神经退行性疾病患者大脑中某些特定突变的Tau蛋白聚集过程。该成果有望加深对此类疾病病理的了解。相关研究成果已发表在国际学术期刊《Structure》7月20日号上。
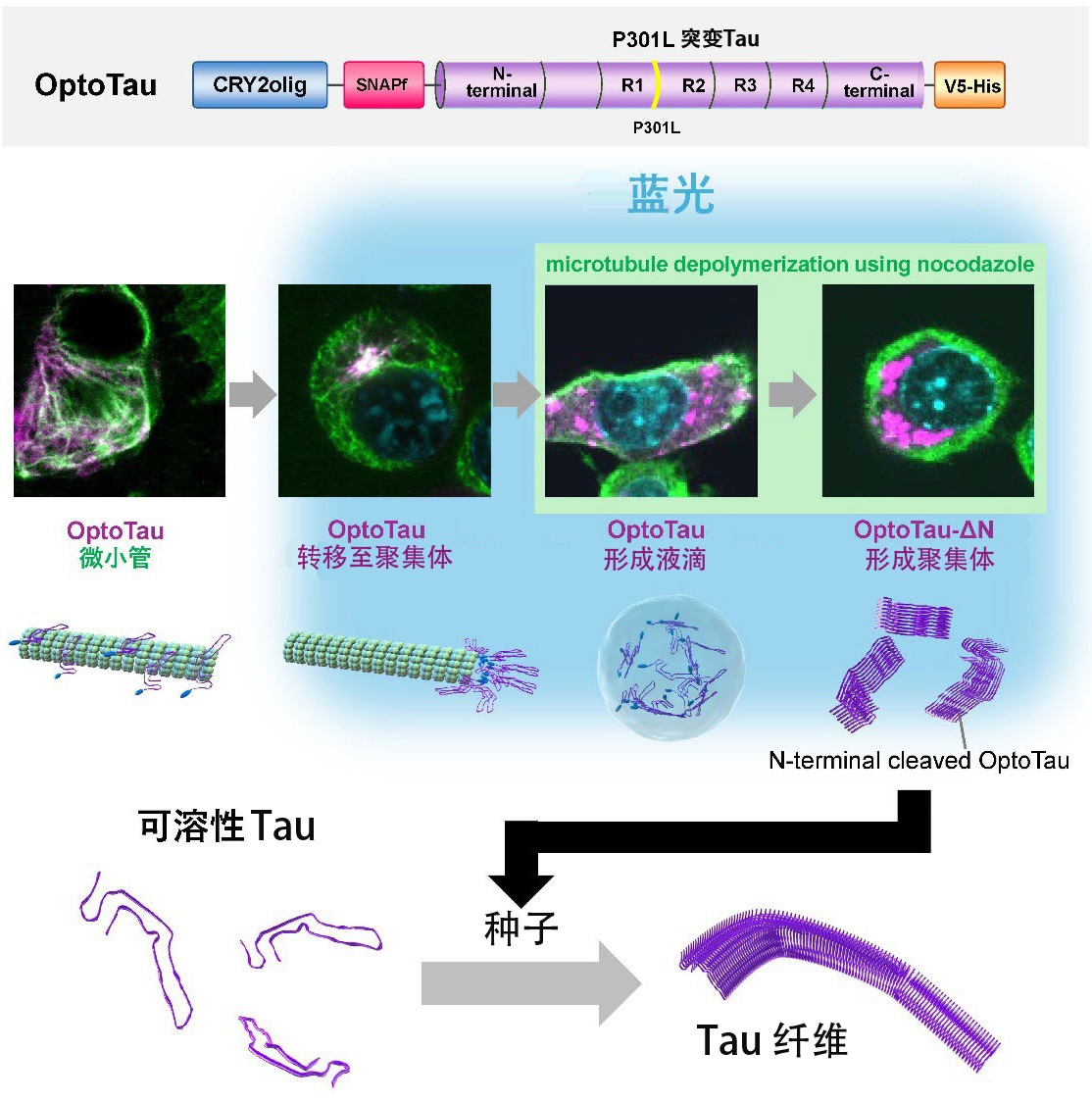
图1 研究成果概要(供图:学习院大学)
Tau蛋白存在于细胞中,并与稳定微管结构的细胞骨架相结合。另一方面,在阿尔茨海默病等神经退行性疾病中,Tau蛋白由于异常磷酸化而与微管脱离,并从水溶性状态变成不溶性团块。
此次研究人员使用带有易于聚集的P301L突变的Tau蛋白与光敏蛋白CRY2olig相融合的Tau蛋白OptoTau,实时操纵了Tau蛋白在响应光照射下的行为变化。
通过使用光响应蛋白CRY2olig(一种源自植物拟南芥的突变蛋白),控制了Tau蛋白的运动,并获得了研究解明疾病进展机制的线索。
在蓝光照射下,OptoTau转变为疾病中观察到的磷酸化状态,并促进了细胞内Tau簇的形成。据观察,这些簇集中在细胞核周围,并隔离在聚集体(一种用于处理聚集蛋白质的系统)中。
当使用微管形成抑制剂(诺考达唑)破坏聚集体时,OptoTau会通过蓝光照射分散到整个细胞中变为非聚集体,形成无膜结构。这被认为是生命科学领域受关注的话题之一、液-液分离(两种或两种以上液体在不混合的情况下形成独立层的现象)形成的液滴,由此得到了Tau蛋白从液滴状结构转变为固体团块的过程。
此外,N端缺失的OptoTau在照射蓝光时会形成比OptoTau更强的聚集体。这表明其发挥了将正常Tau转化为Tau纤维的种子的功能。此外,还发现这种Tau具有将正常Tau转化为异常聚集Tau的能力。
添田助教表示:“本研究是在新学术领域‘奇点生物学’的交流会上,与东京大学的吉村英哲助教以及早稻田大学坂内博子教授共同推进的。此外,也感谢我的上司高岛明彦教授和各位论文合著者给予的大力支持,从而获得了Tau蛋白诱导痴呆症的发展机制线索。今后,我们将利用这些成果挑战寻找可能对Tau靶向认知症药物开发有帮助的抑制剂。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
期刊:Structure
论文:Intracellular Tau Fragment Droplets Serve as Seeds for Tau Fibrils
DOI:doi.org/10.1016/j.str.2024.06.018













