日本和歌山县立医科大学医学部尖端医学研究所生体调节机构研究部的佐佐木泉讲师和改正恒康教授等带领的研究团队发表研究成果称,利用小鼠揭示了内质网应激传感器IRE1α通过炎症小体诱导产生炎症细胞因子IL-1β的机制。研究团队通过向小鼠腹腔注射霍乱毒素分析了基因表达。通过调查小鼠对霍乱毒素的反应发现,霍乱毒素作用于腹腔内的常驻巨噬细胞,通过细胞膜上的糖脂神经节苷脂(GM1)侵入细胞后,到达并积聚在内质网中,诱导内质网应激反应,从而产生IL-1β的机制。该研究成果有望推动多种疾病相关的新型炎症控制药物的开发。相关成果3月22日刊登于国际学术期刊《Cell Reports》上。
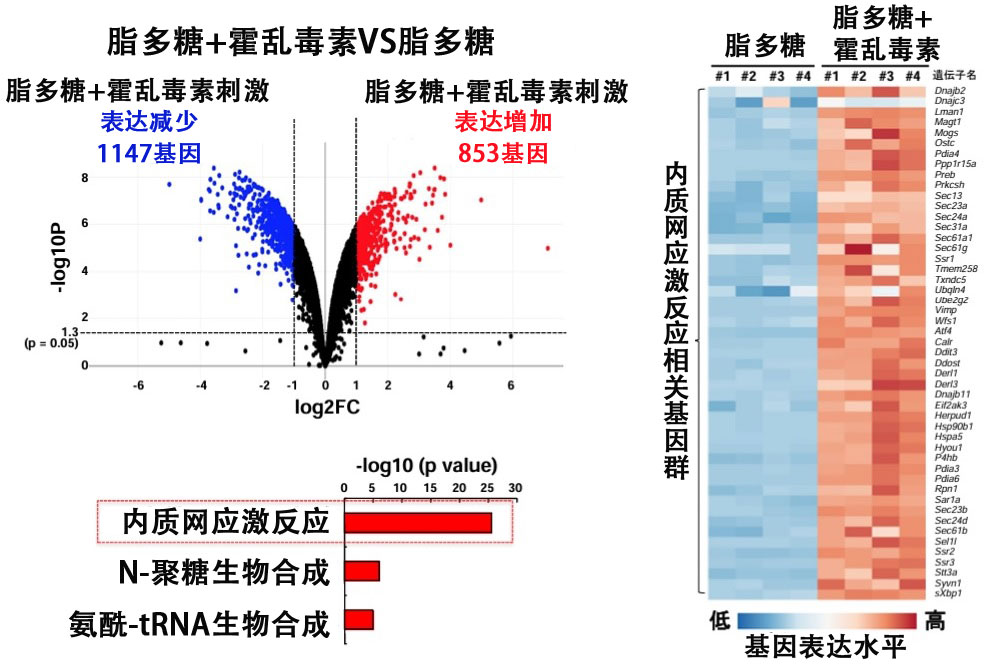
图1 霍乱毒素诱导内质网应激反应(供图:和歌山县立医科大学)
炎症小体是由病原体传感器、蛋白质切割酶及连接两者的分子组成的蛋白质复合物。炎症小体有多种类型,根据各病原体传感器的名称,被命名为NLRP3炎症小体或Pyrin炎症小体。通过这种酶的切割,IL-1β从非活性型转变为活性型,并能够表现出炎症诱导活性。
在病原体感染时,炎症小体通过病原体传感器识别病原体,并参与巨噬细胞产生IL-1β的过程,从而在宿主感染防御中发挥必要作用。另一方面,当其在生物体内与代谢产物发生反应或功能过剩时,会导致自身炎症性疾病和糖尿病等慢性炎症性疾病的发病或恶化。目前已知构成因子的基因突变会造成自身炎症性疾病,如冷炎素(cryopyrin)相关周期热综合征(cryopyrin-associated periodic syndromes,CAPS)和家族性地中海热等。然而,由于难以在生物体内复制,炎症小体具体是如何参与炎症病理的,其机制一直不甚清楚。
迄今为止,研究团队报告了来源于霍乱弧菌的霍乱毒素会对小鼠腹腔中的常驻巨噬细胞产生反应,并诱导产生IL-1β。还揭示了霍乱毒素需要通过与细胞膜上的糖脂神经节苷脂(GM1)结合才能侵入细胞内,随后激活NLRP3和Pyrin炎症小体才能发挥作用。但对于霍乱毒素如何激活炎性小体,此前一直不清楚。
因此,研究团队将霍乱毒素注射到小鼠腹腔内,并对诱导的基因簇进行了全面分析。结果发现有853个基因在霍乱毒素刺激下表达量增加了两倍以上,其中包括许多诱导内质网应激响应的基因。
内质网应激响应是一种消除结构异常的有害蛋白质的机制,这些蛋白质在内质网中积累,通过PERK和IRE1α等内质网应激传感器的活性化引发降解处理或合成停止,从而维持体内平衡。
当通过免疫染色验证霍乱毒素是否确实到达小鼠腹腔内的内质网时,发现其与IRE1α共存并积累。此外,在利用GM1缺陷型巨噬细胞进一步研究内质网反应是否必须通过与霍乱毒素GM1的结合入侵细胞时,结果发现在GM1缺陷型巨噬细胞无法入侵细胞内,并且不会诱导应激反应。
此外,当使用抑制剂检测PERK或IRE1α内质网应激传感器是否参与时,发现只有IRE1α参与IL-1β的诱导,这一结果在利用缺陷小鼠进行的实验中也得到了证实。
霍乱毒素已被证明可以激活NLRP3和Pyrin炎症小体。因此,为了研究IRE1α参与激活哪种因子,研究团队使用IRE1α缺陷的腹腔巨噬细胞并分别添加各种炎症小体激活因子,以研究IL-1β的诱导能力。结果显示任何一种炎症小体活化因子的加入都会削弱产生IL-1β的能力。研究还发现,内质网应激传感器IRE1α是两种炎症小体活性化所必需的。
佐佐木讲师表示:“还有其他未知的内质网应激传感器,而它们的作用在免疫学领域尚未明确。此次,我们通过关注腹腔内的常驻巨噬细胞,希望可以进一步阐明其分子基础。此外,腹腔中常驻的巨噬细胞也存在于人体中,因此可以推测人体内可能也存在类似机制。今后,我们将继续开展面向人类治疗的研究。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Cell Reports
论文:A stress sensor, IRE1α, is required for bacterial-exotoxin-induced interleukin-1b production in tissue-resident macrophages
URL:https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00309-7













