日本东北大学加龄医学研究所(Institute of Development, Aging and Cancer, Tohoku University)肿瘤生物学领域的吉野优树助教、千叶奈津子教授等与该大学研究生院医学系研究科的研究生本成登贵和、石田孝宣教授等人合作,开发出了一种测量来自小鼠肿瘤组织及血液的淋巴母细胞样细胞的同源重组修复活性的方法。利用该方法可以预测癌症治疗药物的效果和诊断遗传性乳腺癌/卵巢癌综合征。相关研究成果发表在期刊《Scientific Reports》上。
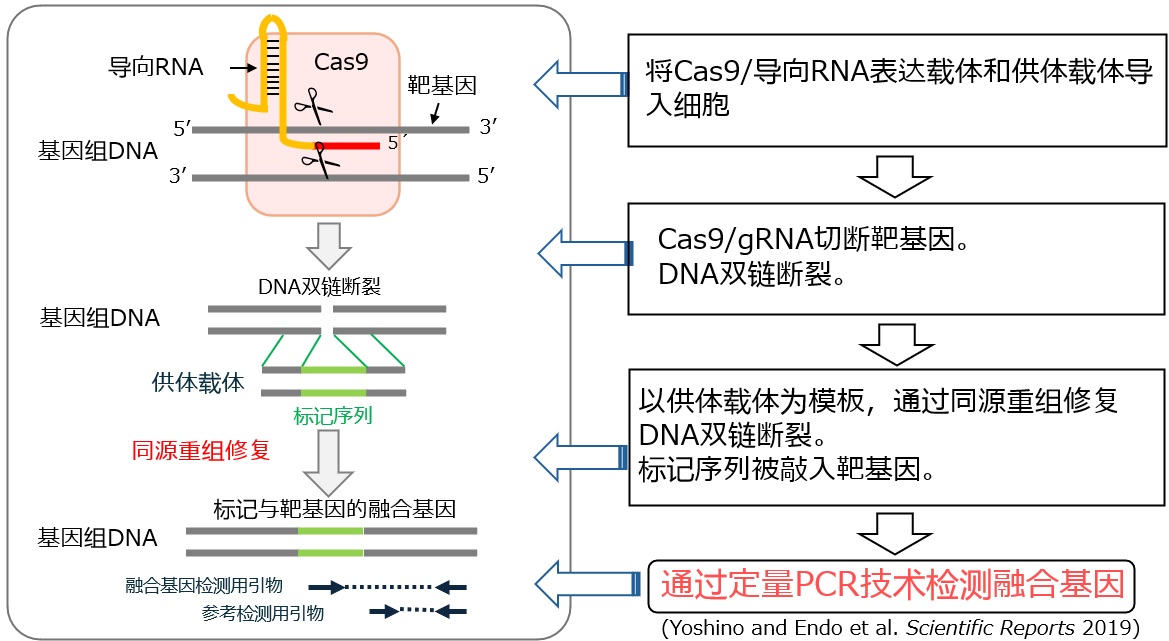
图1 ASHRA的概述(供图:东北大学)
对于同源重组修复DNA双链断裂机制存在异常肿瘤,PARP抑制剂和铂类抗癌药物等被认为有效,而同源重组修复所需要的分子如出现基因异常,则会导致遗传性乳腺癌/卵巢癌综合征。因此,研究人员认为,评估同源重组修复活性将有助于预测癌症治疗的有效性和诊断遗传性乳腺癌·卵巢癌综合征。
此前,临床上评估同源重组修复活性一般使用的是对BRCA1和BRCA2等在同源重组修复中发挥作用的因子进行基因检测的。然而,基因检测不可能检测出所有能引起同源重组修复异常的致病基因,而且发现的基因变化有时无法判断是否为异常。
研究团队利用千叶教授等人开发的同源重组修复活性测量方法ASHRA(Assay for Site-specific HR Activity),成功地直接测定了来自肿瘤组织及血液细胞的同源重组修复活性。
在实施ASHRA时,研究人员向待测细胞中导入测定用载体,其中包括导致基因组DNA断裂的Cas9/gRNA表达载体,以及具备与断裂位点相同序列和检测所需标记序列的供体载体。当基因组DNA上发生的DNA双链断裂利用供体载体进行同源重组修复后,标记序列便被敲入了DNA双链断裂处,从而产生了标记序列与内源性基因的融合基因,此时便可运用定量PCR技术对融合基因进行检测。

图2 小鼠肿瘤组织中的同源重组修复活性测定(供图:东北大学)
研究人员将人癌细胞移植到小鼠体内以形成肿瘤后摘除,然后向肿瘤中注射测定用载体,利用电穿孔法将载体导入肿瘤细胞,即可检测到经过同源重组修复产生的融合基因。该方法测定的同源重组修复活性与向小鼠投用PARP抑制剂“奥拉帕利”时的肿瘤缩小效果表现出高度相关性。
此外,针对血液来源的淋巴母细胞样细胞,通过电穿孔法将测定用载体导入其中后,也可检测同源重组修复活性。并且,在具有单等位基因BRCA1突变的遗传性乳腺癌/卵巢癌综合征的淋巴母细胞样细胞中,检测到同源重组修复活性出现统计学意义上的显著降低。这些结果表明,通过ASHRA进行的遗传性乳腺癌/卵巢癌综合征患者正常细胞——血液来源细胞的同源重组修复活性评估,在诊断中具有应用潜力。
ASHRA可以直接检测出同源重组修复活性的变化,因此研究人员认为,即便是在未知的同源重组修复因子存在异常,或是已知的同源重组修复因子的基因变化异常与否无法判断的情况下,它也能检测出异常。该方法的临床应用有望更有效地诊断癌症治疗和遗传性乳腺癌/卵巢癌综合征。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Scientific Reports
论文:Evaluating homologous recombination activity in tissues to predict the risk of hereditary breast and ovarian cancer and olaparib sensitivity
DOI:org/10.1038/s41598-024-57367-6













