奈良先端科学技术大学院大学先端科学技术研究科的广田俊教授和酒井隆裕(研究生)的研究团队,与筑波大学计算科学研究中心、大分大学研究管理机构、兵库县立大学研究生院理学研究科共同宣布,在针对免疫反应中识别病原体等异物并进行攻击的抗体研究中,发现了一种抗体之间以新模式结合(缔合)的缔合体。通过柱色谱法和X射线晶体结构分析发现,4个抗体结合成四缔合体与单体呈平衡状态存在。该发现有望为新药开发做出贡献。该研究成果已于12月8日刊登在国际学术期刊《Nature Communications》上。
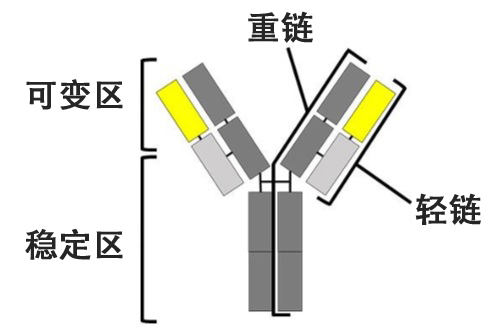
图1.抗体结合模式图(供图:奈良先端科学技术大学院大学)
抗体依靠长短两条蛋白质(免疫球蛋白)结合,在“Y字”型的上部(可变区)识别抗原。轻链位于Y形上侧,其中有可变区和稳定区。利用抗体的抗体药物因具有高疗效和低副作用的特点而受到关注。
然而抗体容易凝集,一旦凝集识别抗原的能力就会受损,凝集体的沉积会对机体造成危害。特别是以错误构造折叠的抗体轻链更容易凝集,进一步导致凝集化和沉积,有可能引起淀粉样变性,从而导致器官功能障碍。
另一方面,抗体凝集体在原子水平上的构造尚不清楚。如果能够特定抗体轻链的缔合状态,就有可能得到对提高质量有帮助的知识。
为此,研究人员采用柱色谱法这一分析蛋白质大小的方法和X射线晶体结构分析进行研究,并发现了在缔合和解离之间取得平衡的抗体轻链。
此外,研究人员还成功地结晶出了四缔合体样品,并使用大型同步辐射设施SPring-8的X射线在原子水平上确定了其分子结构。结果表明,可变区通过分子间交换一部分相同立体结构的现象——三维结构域交换(3D domain swapping)而缔合,形成二缔合体,该二缔合体进一步二缔合化后形成四缔合体。
在三维结构域交换后的二缔合体之间的相互作用界面上,存在很多疏水性氨基酸残基,这些残基的疏水性相互作用,阻止了水分子的影响,使四缔合体呈现稳定化。
此次发现的新的缔合状态被认为能有效稳定抗体,有利于开发设计出更易处理的新型抗体药物。
广田教授表示:“近年来,抗体作为药品备受关注,但凝集导致不能使用成了一大问题。而且‘凝集’有各种各样的形式,原子水平上抗体的凝集机理几乎是未知的。通过此次的研究成果,我们了解到三维结构域交换这一现象在抗原识别部位发生,从而提高了稳定性。期望这些信息有助于未来抗体药物的开发”。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:《Nature Communications》
论文:Structural and Thermodynamic Insights into Antibody Light Chain Tetramer Formation through 3D Domain Swapping
URL:www.nature.com/articles/s41467-023-43443-4