岩手大学理工学部的尾崎拓副教授等的研究团队与弘前大学共同发表研究成果称,阐明了局部存在于线粒体中的酶蛋白——“钙蛋白酶-5(Calpain-5)”可以激活促进炎症反应的分子,从而导致脑缺血再灌注损伤。研究发现,在小鼠脑细胞中,线粒体的钙蛋白酶-5比细胞质的钙蛋白酶-5更主动地参与炎症反应。在人脑梗塞部位周围的细胞中,钙蛋白酶-5的表达量也出现增加。该研究成果有望促进抑制再灌注损伤药物的开发。相关成果已发表在国际学术杂志《Biochimica et Biophysica Acta-General Subjects》11月9日号上。
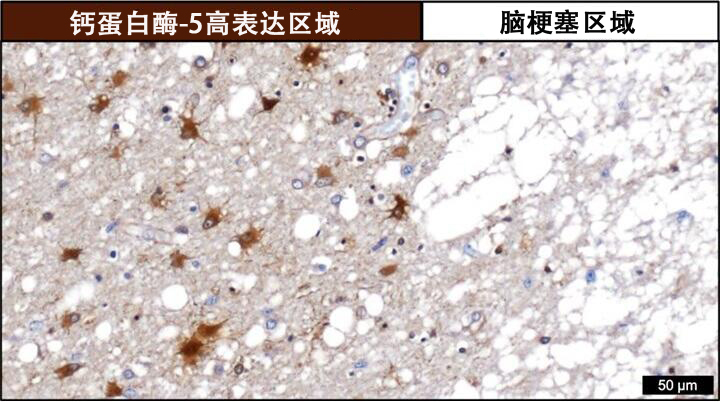
图1钙蛋白酶-5高表达的人脑梗塞区域周边部分染色图(棕色区域的钙蛋白酶-5含量高)(供图:岩手大学)
在脑梗塞和心肌梗塞中,血流量会减少(缺血),为了防止由此引起的细胞死亡,在出现动脉硬化或血栓时,会通过快速手术或血栓溶解药物进行治疗,使血流恢复正常。另一方面,伴随血流恢复(再灌注),会引发炎症反应,由此造成的再灌注损伤比缺血时更为广泛。在这种缺血再灌注损伤中,未因缺血受损的细胞也会因再灌注而受损,尤其是神经细胞特别容易受到这种损伤,从而加剧病情恶化。然而,缺血再灌注损伤的详细机制目前尚未明确。
钙蛋白酶是一种钙依赖性半胱氨酸中性蛋白酶,人类中已发现15种类型。
在此之前,研究团队已经发现,在细胞内功能不明的钙蛋白酶-5局部存在于线粒体中,且相比同样存在于细胞质中的钙蛋白酶-5而言其对钙信号更敏感。此外还证实,在内质网应激过程中,线粒体中的钙蛋白酶-5会激活促进炎症反应的Caspase-4(半胱胺酸蛋白酶蛋白-4),但尚不清楚钙蛋白酶-5在生物体内是否也参与炎症反应。
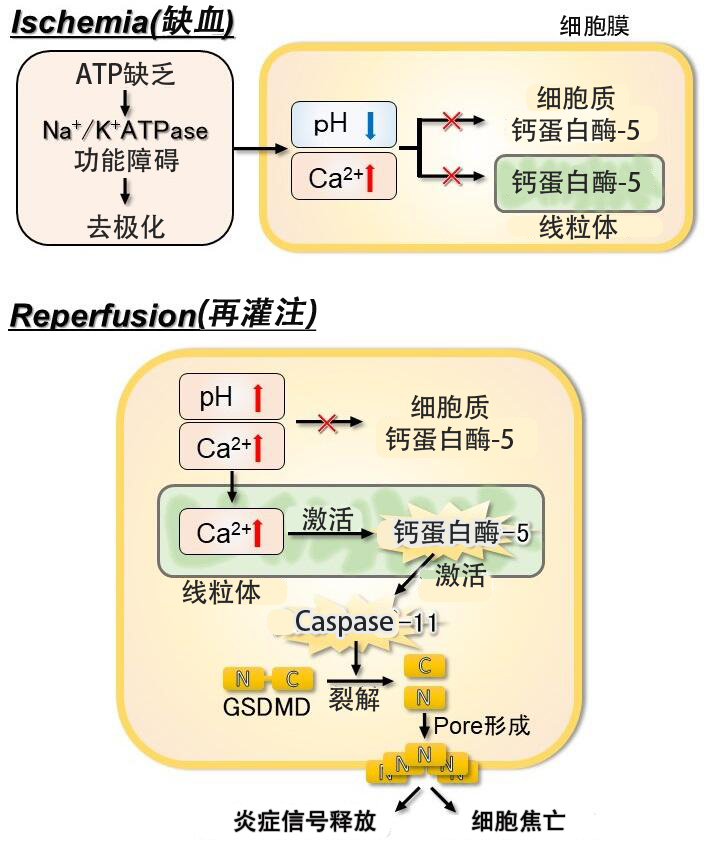
图2本研究揭示的缺血再灌注损伤的细胞内分子机制模型(供图:岩手大学)。
因此,在本研究中,研究团队分别分离了小鼠大脑中的细胞质和线粒体的钙蛋白酶-5,并比较了各自的钙反应。结果发现,线粒体钙蛋白酶-5的反应速度更快,且更主动地发挥功能。
此外,在脑梗塞模型小鼠的大脑中,发现线粒体钙蛋白酶-5在再灌注后初期就被激活。免疫组织化学染色显示,线粒体钙蛋白酶-5主要在神经细胞中表达。
为了研究钙蛋白酶-5在神经细胞中的功能,研究人员对小鼠海马源神经细胞株中钙蛋白酶的功能进行抑制后发现,参与炎症信号传导和诱导细胞死亡的Caspase-11(酶)的活化受到抑制。目前已知,Caspase-11的活化可通过细胞内GSDMD蛋白的裂解诱发炎症等。
此外,还发现钙蛋白酶-5在人脑梗塞患者的梗塞部位周围神经细胞脱落区域特异性高表达,其后发现在神经胶质细胞的星形胶质细胞中同样高表达。
研究人员据此认为,神经细胞中的线粒体钙蛋白酶-5在大脑缺血再灌注损伤的初期就已发挥作用,并在末期促进星形胶质细胞的组织损伤。
尾崎副教授表示:“我们目前正在努力寻找能够特异性抑制钙蛋白酶-5的化合物。致力于在脑梗塞发生后,通过与血栓溶解药物等并用成为抑制缺血再灌注损伤的特效药。线粒体被认为起源于细菌,并在人类进化过程中融入和共生,但与哺乳动物共生有什么好处呢?今后我们将继续研究,阐明人类与线粒体之间的关系”。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Biochimica et Biophysica Acta - General Subjects
论文:Role of calpain-5 in cerebral ischemia and reperfusion injury
URL:doi.org/10.1016/j.bbagen.2023.130506













