目前虽然许多癌症的生存率在不断提高,但胰腺癌仍是最难治的癌症,其5年生存率仅为6%,发现时往往为时已晚。京都大学医学研究科消化器内科学的益田朋典医员、福田晃久讲师、妹尾浩教授、分子肿瘤学的野田亮名誉教授等人组成的研究团队发布研究成果称,发现膜蛋白RECK的表达减少在胰腺癌的发病和转移中起着重要作用。野田名誉教授表示:“RECK基因在癌症中发生突变的情况很少。由于该基因并没有破损,只是失活了,因此通过使用激活药物,或许能够开发出胰腺癌的新治疗方法”。相关成果已刊登在《Journal of Clinical Investigation》杂志在线版上。
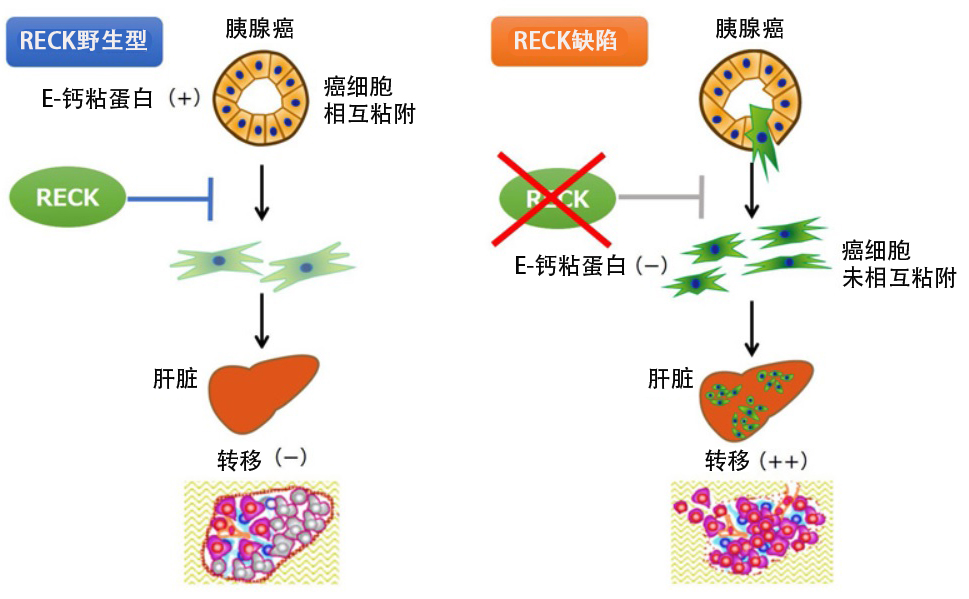
图 RECK通过增加E-钙粘蛋白的表达来抑制胰腺癌细胞的浸润和转移。(供图:京都大学)
RECK(Reversion-inducing Cysteine-rich protein with Kazal motifs)是在寻找能使因癌基因K-RAS恶性转化的小鼠成纤维细胞恢复正常的基因过程中发现的一种膜蛋白。它具有多个功能域,已知可抑制细胞表面的蛋白质分解并协助信号转导。尽管RECK基因突变在许多癌细胞中很少见,但已知其表达量低于正常组织。
研究团队制作了具有多种导致胰腺癌的基因突变的KPC小鼠。在KPC小鼠中,尽管RECK在癌前病变中表达,但在胰腺癌中表达显着减少或消失。人胰腺癌组织也是如此。
在引入了几乎存在于所有胰腺癌病例的Kras基因突变的KC小鼠中,只有10%的小鼠患上了胰腺癌。另一方面,在引入Kras基因突变的同时胰腺特异性敲除RECK后发现,胰腺癌发病率升高,并且发生肝转移。
RECK基因敲除小鼠所患的胰腺癌中,细胞间粘附所需的E-钙粘蛋白的表达明显减少,并转变为在组织学上更容易浸润的间质系性状。此外,所有添加p53杂合性缺失的KC小鼠均形成胰腺癌,但并未发生肝转移,而当RECK被敲除时,肝转移发生率提高。换言之,RECK可以抑制胰腺癌的发病和转移。
研究人员还以患胰腺癌的KPC小鼠为对照,对源自胰腺上皮的细胞进行了细胞谱系分析。结果发现,在KPC小鼠的胰腺癌中,间质中完全没有观察到胰腺上皮细胞来源的细胞,而当RECK被敲除时,观察到大量源自胰腺上皮且E-钙粘蛋白阴性的间质细胞。换言之,RECK基因的敲除改变了小鼠体内胰腺癌细胞的性质,使其从上皮细胞变为间质细胞。
此外,在RECK基因敲除的胰腺癌细胞中,使用逆转录病毒在胰腺癌细胞中重新表达RECK时,发现浸润能力降低。使用肝转移模型的详细分析表明,在RECK基因敲除的胰腺癌细胞中,由于E-钙粘蛋白的表达减少,导致细胞特性变为间充质系。敲除RECK还会导致基质金属蛋白酶 (MMP2/MMP3) 的表达增加,从而裂解细胞表面蛋白,并降低E-钙粘蛋白的表达。
对源自患者的人胰腺癌组织的分析也证实,RECK表达量低的人胰腺癌E-钙粘蛋白表达低,远处转移多,分化程度低,且预后较差。此外,所分析的9种人胰腺癌细胞株均未表达RECK蛋白。
上述结果表明,RECK可以增加E-钙粘蛋白的表达并抑制胰腺癌的发病、上皮间质转化和转移,并且通过重新表达RECK抑制胰腺癌的转移。
福田讲师表示:“我们已经发现了一种可以增加RECK表达的低分子化合物,今后,我们将以该化合物为基础,致力于开发出抑制胰腺癌浸润、转移和增殖的药物”。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Journal of Clinical Investigation
论文:Pancreatic RECK inactivation promotes cancer formation, epithelial-mesenchymal transition, and metastasis
DOI:doi.org/10.1172/JCI161847













