京都大学iPS细胞研究所(CiRA)的北悠人研究员(研究当时)和堀田秋津副教授等人组成的研究团队发表研究成果称,开发出了一种诱导杜氏肌营养不良(DMD)患者来源的iPS细胞进行外显子跳跃的双重CRISPR-Cas3系统。利用两个CRISPR-Cas3,可一次性剔除存在于该疾病中的外显子45~55区域的大片段基因。研究团队对利用源自患者细胞的iPS细胞使用该系统后,确认抗肌萎缩蛋白得到了恢复。该成果有望为开发新的DMD治疗方法提供帮助。相关研究成果已于2023年8月15日发表在国际学术期刊《Stem Cell Reports》上。
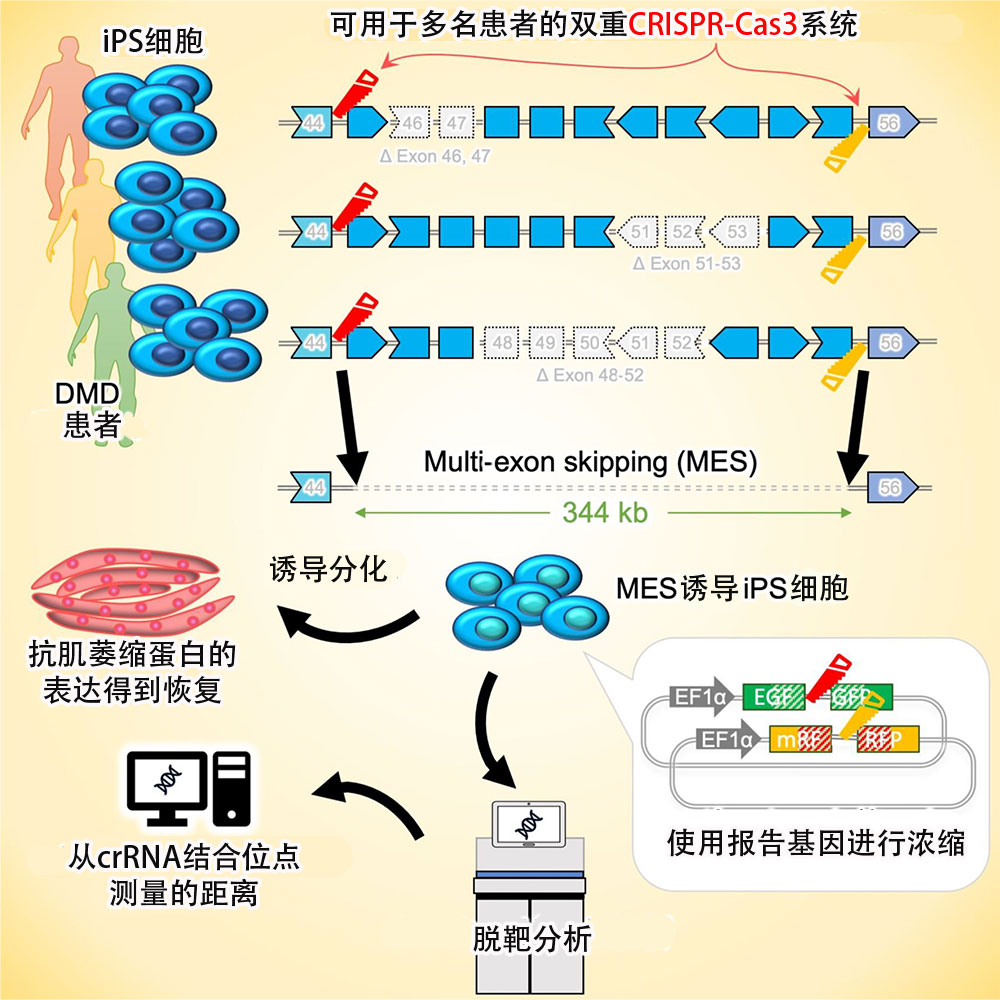
图1 研究概要(供图:京都大学)
DMD是一种维持肌细胞的重要蛋白质——抗肌萎缩蛋白的基因突变引起的全身肌肉萎缩性X连锁性遗传病,主要发病于男性儿童,是儿童发病率最高的肌肉萎缩症。日本约有2000至3000名患者,平均寿命较短,约31岁。
抗肌萎缩蛋白基因是由79个外显子组成的巨大基因,其中任何一个外显子发生突变都会导致抗肌萎缩蛋白的功能障碍从而引发肌肉萎缩症。突变的位置因人而异,迄今为止研究人员一直在开发针对不同突变位置来恢复抗肌萎缩蛋白的方法。其中,外显子跳跃备受关注,NCNP等组织已在日本和美国等地销售可以跳过外显子53的核酸药物。
约有60%的患者在外显子45~55的区域位置(344kb)中发生突变,有报道称,通过诱导多外显子跳跃(MES)一次性跳过该领域可以恢复在该区域存在突变的患者的抗肌萎缩蛋白。缺失该区域的患者被分类为轻度的贝克型,几乎没有肌肉症状。
然而,已普及的CRISPR-Cas9仅能实现数b单位上极小片段的缺失,难以实现大片段基因组缺失。
对此,研究团队考虑使用两个比CRISPR-Cas9能对更大片段进行基因编辑的CRISPR-Cas3系统,制作一个从两端删除外显子45~55区域基因的双重CRISPR-Cas3系统。CRISPR-Cas3系统是在日本开发,可缺失20至60kb的片段。
结果发现,该系统与Cas9相比,虽然效率较低但可以更有效地诱导MES。另外研究团队还开发出对缺失成功的细胞群进行浓缩的方法。
研究团队使用该系统对相同范围但基因突变位置不同的3名DMD患者的细胞所制备的iPS细胞进行了MES诱导。
结果显示,无论是哪个患者来源的iPS细胞,最终都得到了成功删除了344kb的该区域片段的细胞。通过将其诱导为骨骼肌,确认MES诱导之前不能产生抗肌萎缩蛋白的患者细胞,现在可以产生抗肌萎缩蛋白。
此外还通过全基因组分析确认到,MES诱导的各细胞没有发生预期之外的缺失(脱靶效应)。
使用该系统制备的细胞可用于修复因病情发展而丧失的肌肉。
堀田副教授表示:“通过使用该系统,即使有数百名患者,也可以使用相同的方法恢复抗肌萎缩蛋白。我们的目标是以非常简单的方式低成本地实现治疗用细胞的生产线。如果今后运输技术发展到能将CRISPR-Cas3送至体内,我们认为可以将其应用于体内基因治疗(In vivo Gene Therapy),在患者体内恢复抗肌萎缩蛋白。”
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
杂志:Stem Cell Reports
论文:Dual CRISPR-Cas3 system for inducing multi-exon skipping in DMD patient-derived iPSCs
DOI:10.1016/j.stemcr.2023.07.007