东京医科齿科大学难治疾患研究所的冈泽均教授和藤田庆太非常勤讲师等人组成的研究团队与东京都健康长寿医疗中心合作,发现了帕金森病致病蛋白质α-突触核蛋白(α-synuclein)的新搬运模式。研究团队对小鼠脑中α-突触核蛋白的扩散情况进行分析后发现,α-突触核蛋白以单体形式通过脑内淋巴系统快速搬运到远处区域并在到达处形成聚集体。这一发现可能意味着与异常蛋白密切相关的神经退行性疾病也具有同样机制,有望成为这些疾病的治疗新靶标。相关研究成果已于2023年8月8日发表在国际学术期刊Cell Reports上。
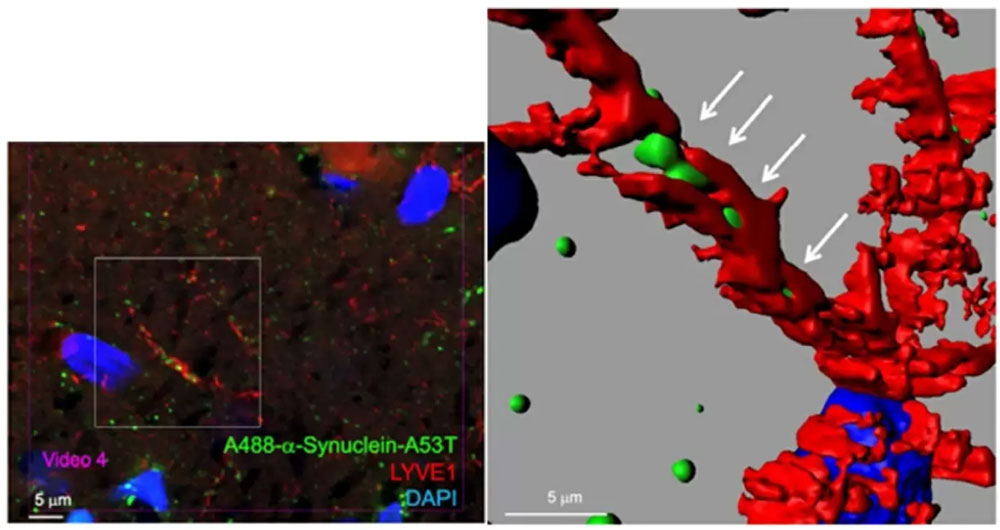
图1:使用超高分辨率显微镜观察脑内淋巴管中α-突触核蛋白的搬运过程。右图为左图局部经图像处理软件放大处理后的结果。(供图:东京医科齿科大学)
帕金森病是一种典型的神经退行性疾病,在日本有大约20万患者并呈增加趋势,其特征是脑神经细胞内α-突触核蛋白(α-synuclein)的积累和聚集。一般认为α-突触核蛋白从肠道神经细胞经过通过迷走神经搬运到脑干,进而导致异常蛋白质像感染病毒那样增加(Prion假说),能观察到异常蛋白质凝聚的疾病,如阿尔茨海默病等可能也具有同样的病理。已经有研究显示,在给帕金森病患者移植的胎儿神经元中观察到了α-突触核蛋白的凝聚体,将α-突触核蛋白凝聚体注入小鼠脑后观察到了路易体(蛋白质聚集体),小鼠出现了类似帕金森的症状。
本次研究团队使用嗅球投射外侧前额叶处长期表达α-突触核蛋白的小鼠模型,对来自患者的α-突触核蛋白是如何在脑内扩散的情况进行了调查。嗅球被认为是α-突触核蛋白传达的途径之一。
研究发现,α-突触核蛋白在用药2周内扩散到整个大脑,神经细胞内也得到了确认,α-突触核蛋白以小分子单体的形式到达了距离注入点较远的区域。12个月后确认到,α-突触核蛋白在到达处形成了聚集体。
此前主流的假设认为,α-突触核蛋白是在先形成聚集体后再经神经元传达到另外一个神经元的。但这种假设与到达距离脑部远处的α-突触核蛋白为单体形式的现象不一致。
对此,研究团队使用超高分辨率显微镜从多个角度对血管内皮细胞和α-突触核蛋白之间的位置关系进行了调查。结果显示,在血管内部并不存在α-突触核蛋白单体。之后用同样方法调查了α-突触核蛋白单体与淋巴管上皮细胞的位置关系,结果在淋巴管内确认到了α-突触核蛋白。
研究人员认为,α-突触核蛋白是沿着血管外部延伸的大淋巴管分支,最终到达神经元,并在神经元内部成长为聚集体的。
由于病源α-突触核蛋白单体被迅速搬运到大脑全域,因此病情的发展可能比此前认为的更快。本次研究明确的α-突触核蛋白搬运模式并没有否定此前的假设,而是揭示了淋巴管这一α-突触核蛋白的新搬运途径。
迄今为止,神经退行性疾病的治疗药物主要以聚集体为靶点,但本次研究表明,若以更小的α-突触核蛋白单体和寡聚体为靶点,有可能开发出更有效的治疗药物。另外,淋巴系统在大脑中的作用还有许多不明之处。
冈泽教授表示:“关于淋巴管的研究仍处于初期阶段,我想知道该领域的研究人员会如何看待此次发现。同时,我们也还将继续研究如何阻断神经退行性疾病在神经元内外的毒性。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Cell Reports
论文:Mutant α-synuclein propagates via the lymphatic system of the brain in the monomeric state
DOI:doi.org/10.1016/j.celrep.2023.112962













