抗癌药物通过诱导癌细胞凋亡(Apoptosis)而发挥治疗作用。然而,具有抗药性的癌症或转移性癌症等,会对现有的以细胞凋亡为靶向的抗癌药物产生抗药性,但对铁死亡(Ferroptosis)变得脆弱。因此,以诱导癌细胞发生铁死亡或提高细胞铁死亡敏感性为目标的癌症治疗药物开发受到了全球的关注。近日,日本东北大学的三岛英换非常勤讲师(德国亥姆霍兹慕尼黑研究中心的高级研究员)和亥姆霍兹慕尼黑研究中心博士生中村俊崇在《Nature》杂志上分别发表了关于铁死亡的论文。
研究概要(供图;东北大学)
铁死亡是细胞内脂质氧化过度导致细胞膜破裂而发生的细胞死亡,于2012年由Brent R Stockwell博士发现。作为生物体内存在防止过量脂质氧化,抑制铁死亡的机制,也即谷胱甘肽过氧化物酶(GPX4)通路和铁死亡抑制蛋白1(FSP1)通路。阻碍这两条通路便可诱导铁死亡,但GPX4在结构上缺乏与抑制剂结合的合适位点,抑制后对正常细胞也有影响。另一方面,FSP1基因敲除的小鼠仍可正常发育,因此预计不会产生严重的副作用,抑制剂结合位点也有多个。
三岛和中村所在实验室的Conrad博士等人首先开发出了FSP1抑制剂iFSP1,但该药剂在体内不稳定,多以在动物体内无法发挥预期的效果。
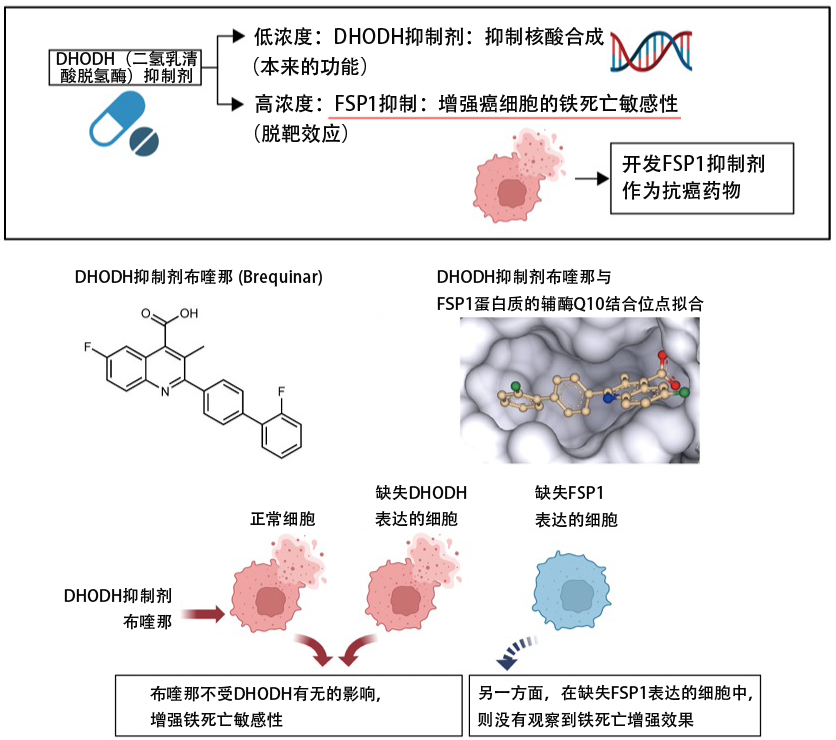
三岛阐明了能提高癌细胞铁死亡敏感性的DHODH抑制剂的作用机理。DHODH是合成核酸所必需的酶,DHODH抑制剂之一的布喹那,作为针对白血病等抑制癌细胞增殖的抗癌药物正在进行临床试验。有报道显示,DHODH通过还原线粒体内的辅酶Q10抑制铁死亡。但是,在本次的研究中发现,要想发挥布喹那提高铁死亡敏感性的效果,所需的剂量需要比在人类细胞和小鼠的实验中抑制DHODH作用所需的剂量高100倍以上。由于布喹那和iFSP1有部分相似的结构,三岛推测“这可能是脱靶效应”,并对此进行了研究。
在试管中混合FSP1和药物,评价酶活性时发现,布喹那在高浓度时也能抑制FSP1。另外,在结构预测分析中也发现,布喹那可以与FSP1的辅酶Q10结合位点拟合。相反,在敲除FSP1表达的细胞中,则没有观察到布喹那增强铁死亡的效果。此外,其他DHODH抑制剂也证实了同样能提高癌细胞铁死亡敏感性的效果。也就是说,DHODH抑制剂在高浓度时也是FSP1抑制剂,并且通过抑制FSP1来提高癌细胞的铁死亡敏感性。
中村发现了一种新的FSP1抑制剂icFSP1,并确认了它具有促进铁依赖细胞死亡的作用。利用抑制FSP1就会产生铁死亡的FSP1表达GPX4缺失细胞,对约一万种化合物进行筛选,从中确定了icFSP1。并确认了icFSP1能够浓度依赖地诱导各种癌细胞发生铁死亡。使用荧光显微镜观察作用机制时发现,加入icFSP1后,FSP1从其他蛋白质中分离出来并凝聚,从而相分离并诱导铁死亡。此外,对植入黑色素瘤的小鼠进行腹腔注射icFSP1后,还确认到能够抑制癌症的增殖。中村说:“这种药物在生物体内的稳定性等还不够完善,所以我们正在进行不同的化学修饰,以开发出具有更高生物体内稳定性的化合物。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Nature
论文:DHODH inhibitors sensitize to ferroptosis by FSP1 inhibition.
DOI:10.1038/s41586-023-06269-0













