近畿大学医学部伊藤彰彦主任教授和富山大学尖端抗体医药开发中心高冈裕副主任(教授)、东北大学研究生院医学系研究科佐藤文俊特任教授、广岛大学研究生院医系科学研究科冲健司讲师与伦敦玛丽女王大学共同发布研究成果称,发现 “原发性醛固酮增多症”高血压病的病因是由粘附分子“CADM1”的基因突变引起的。CADM1分子存在变异会引发细胞间通讯不良,导致醛固酮分泌过多,从而引发高血压。该研究成果将有助于高血压病的诊断和治疗药物的开发。相关成果已发表在国际学术杂志《Nature Genetics》6月8日号上。
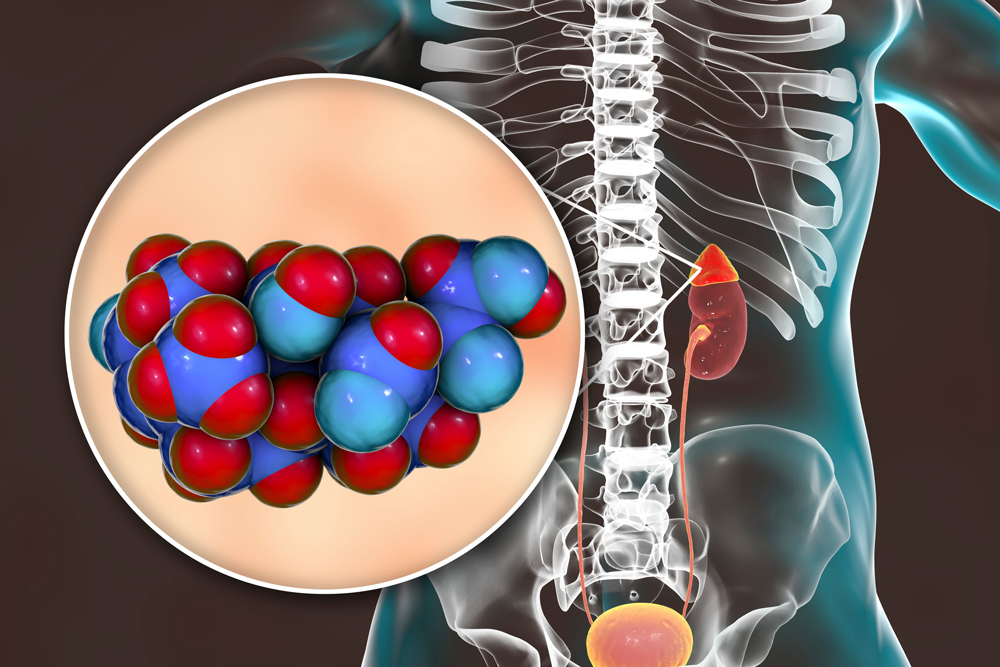
肾上腺皮质和醛固酮(供图:近畿大学)
原发性醛固酮增多症是由于肾上腺皮质分泌的醛固酮(激素)过多而导致高血压的病状,据推测约占高血压病整体(日本推定患者人数4300万人)的10%,以及约占药物难以发挥作用的治疗抵抗性高血压病的20%。与一般的高血压病相比,这种高血压病症多伴有心脏和血管并发症,因此需要多加注意。肾上腺皮质中产生醛固酮的腺瘤(良性肿瘤)等发生病变,虽然可通过切除该病变进行治疗,但病变较小时往往难以发现,因此存在变成难治性高血压的可能性。作为过度分泌的致病基因,此前已经鉴定出了部分基因突变,但仍有一些原因不明的病例。
在本次研究中,研究团队发现导致该疾病的原因是产生醛固酮的腺瘤中CADM1基因的突变。这种突变是联合研究人员伦敦大学的莫里斯·布朗博士从一例该疾病患者身上切除的肾上腺中发现的。在莫里斯·布朗博士的提议下,欧洲、美国、日本在探索和研究该变异的国际联合研究中发现了6例该基因的变异。该基因是细胞膜蛋白基因,该蛋白贯穿细胞膜1次,在细胞外区域的分子结合位点与相邻细胞的同一位点连接,起到细胞间粘附分子的作用,在细胞间形成适当的间隙。6例突变均发生在该分子贯穿细胞膜的位点,形成单个氨基酸置换(G379D或V380D的其中之一)。
首先,在肾上腺皮质细胞中表达变异型CADM1,发现醛固酮分泌显著增加。调查产生醛固酮的腺瘤中CADM1的表达后发现其在细胞膜上高度表达,推测与粘附分子有关。
因此,研究团队通过计算机模拟分析了CADM1的分子结构如何随着贯穿区域的单个氨基酸置换而发生变化。
结果发现,这种突变使跨膜结构域缩短,从而增加了贯穿角度,导致细胞间距扩大。在正常型中,CADM1以斜着插入细胞膜上的方式存在(与细胞膜成49度),而发生突变时该角度变得接近于垂直(与细胞膜成62度或90度)。模拟结果显示,正常型的细胞间距离约为20nm,而突变型细胞间距因突变而异,约扩大至25nm。
此次,研究团队着眼于负责细胞间通讯的连接蛋白复合物形成的间隙连接,并研究了该连接随着细胞间距的扩大发生不良的可能性。间隙连接通过在每个细胞膜上连接成对的复合物,从而在细胞之间移动离子和分子。
具体来说,就是在单层培养的肾上腺皮质的正常型CADM1和突变型CADM1的细胞中,添加只能通过间隙连接在细胞之间移动的色素并进行比较。
结果发现,在正常型中色素通过间隙连接扩散,而在突变型中色素不会扩散并且间隙连接出现不良。此外,通过向肾上腺皮质培养细胞中添加间隙连接抑制剂,确认了醛固酮的过量产生。
这是首次发现间隙连接不良可能引发高血压病。
一般认为,CADM1基因突变的发生率约为1%,并且人种之间存在较大差异。
伊藤主任教授表示:“间隙连接不良不一定是由基因突变引起的,例如在蛋白质分解亢进等一定病态下也可能发生。对于此类病状中发生的因醛固酮分泌过多而导致的高血压,有望用新的治疗药物或转用现有的治疗药物来治疗。未来,我们将以是否实际存在这样的高血压病作为研究课题,进一步深入研究。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Nature Genetics
论文:Somatic CADM1 mutations in aldosterone-producing adenomas and gap junction-dependent regulation of aldosterone production
URL:nature.com/articles/s41588-023-01403-0













