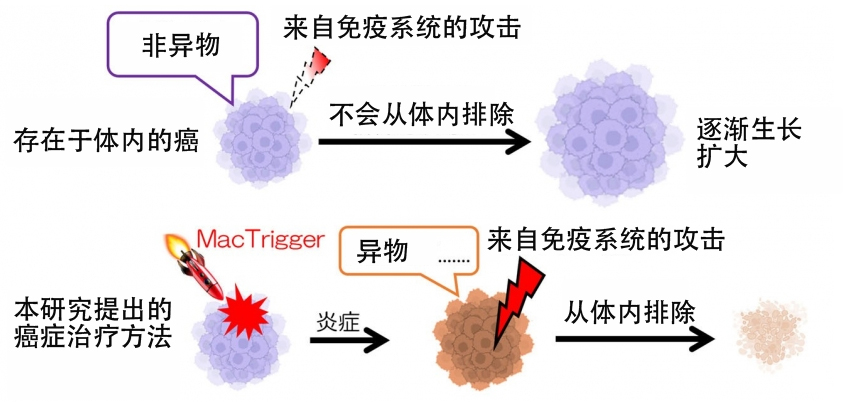
将癌组织转变为急性炎症组织,让免疫细胞对其进行攻击——日本九州大学研究生院工学研究院的新居辉树助教、片山佳树教授、一贯制博士课程4年级学生谷户谦太等人组成的研究团队在世界上首次开发出了用癌症引发炎症的细胞药物“MacTrigger”。该细胞药物采用了非直接攻击癌细胞,转而利用巨噬细胞激活人体排异功能的新概念。新居助教表示:“将努力在10年内开始临床试验”。相关研究成果已刊登在《Journal of Controlled Release》上。
研究概念图(供图:九州大学)
癌细胞会通过释放多种物质来躲避人体免疫细胞的攻击。PD1抑制剂虽然可以防止这种免疫躲避,但其效果因患者不同存在很大差异。
此次研究团队着眼于免疫细胞之一的巨噬细胞。已知巨噬细胞会积极聚集在癌细胞附近,这些聚集的巨噬细胞会从普通型(M0型)向抗炎症型(M2型)极化。研究团队利用巨噬细胞的这一特性开发了转基因巨噬细胞“MacTrigger”,在巨噬细胞极化为M2型时,能够立即释放炎症因子TNFα(肿瘤坏死因子α)。新居助教介绍说“TNFα是各种炎症因子中最好的。这是因为我们受伤时最先出现的就是TNFα。”
MacTrigger被编程为在到达癌症部位后大约4天内消失。将MacTrigger注射到大肠癌小鼠体内8天后确认了抗癌效果。具体效果为,肿瘤内NK细胞(自然杀伤细胞)的比例从约1%增加至约5%,杀伤性T细胞从约6%增加至约15%。在给药第16天的阶段,与未治疗组相比,给药组的肿瘤体积缩小到了3分之1左右,存活率也上升到100%(未治疗组约为20%)。
但是,如果这种引起炎症的物质作用于全身,将会十分危险,因此,为了使MacTrigger只对癌症部分发挥作用,研究团队加入了只要从癌细胞释放的精氨酸酶-1不超过一定水平,TNFα就不会大量释放的锁定功能。在没有锁定功能的情况下,观察到肝肥大和血液中AST(谷草转氨酶)值升高现象,但通过导入锁定功能,已确认可以避免这些问题。
迄今为止,巨噬细胞由于基因导入率低,作为细胞药物并未受到太多关注。研究团队研究了多种提高巨噬细胞转基因导入效率的基因重组方法,通过药物筛选选出基因导入细胞,成功获得了可用于治疗水平的细胞量(100万个)。
新居助教表示:“为了应用于实际治疗,必须减少细胞数,所以我们正在进行各种尝试。另外,我们还在研究今后能否用血液单核细胞制作MacTrigger。将来的目标是实现利用采血制作MacTrigger,并用于癌症治疗。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Journal of Controlled Release
论文:Engineered macrophages acting as a trigger to induce inflammation only in tumortissues based on arginase 1-responsive TNF-α accelerated release
DOI:10.1016/j.jconrel.2023.04.010













