京都大学集成细胞材料科学研究所(iCeMS)客座副教授龟井谦一郎(兼任纽约大学阿布扎比分校副教授)、研究生院工学研究科工学基础教育研究中心的平井义和讲师、微工程专业杨建东博士等人组成的研究团队,使用微流路研发了可在体外模拟再现非酒精性脂肪性肝病(NAFLD)的肠肝脏器模式芯片。目前NAFLD尚未开发出有效的诊断及治疗药物,研究成果有望促进病状的阐明和新治疗药物的开发。相关研究成果已发表在《Communications Biology》上。
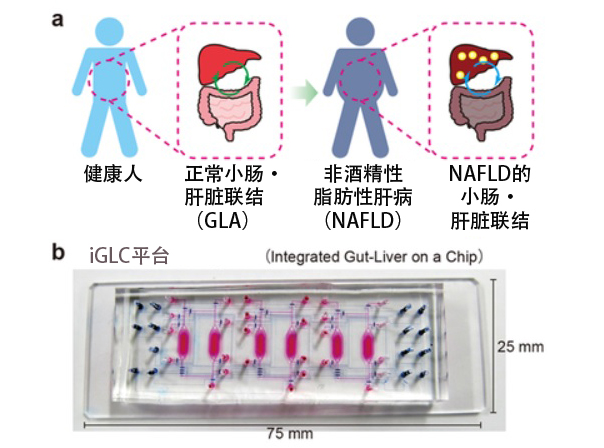
图(a)非酒精性脂肪性肝病(NAFLD;Non-alcoholic fatty liver disease)的小肠·肝脏联结(GLA)。(b)模拟GLA的iGLC平台(Integrated Gut-Liver on a Chip)(供图:京都大学)
全球患者人数持续增加的NAFLD(Non-alcoholic fatty liver disease,非酒精性脂肪性肝病)是一种慢性肝病,可导致脂肪肝、肝硬化、癌症和心血管疾病。一旦演变为重症,肝移植是唯一的治疗手段,但找到供体非常困难。由于NALFD发生在一个高度复杂的过程中,因此其疾病机理目前尚不明确。而药物开发需要深入了解每个过程。
龟井客座副教授和平井讲师一直以来都在共同致力于生物组织芯片的开发。此次开发的被称为iGLC平台(Integrated Gut-Liver on a Chip)的肠肝脏器模式芯片就是其中之一。
iGLC平台在芯片内配备了可以精确控制细胞培养液流动的微阀和泵,实现了分别连接各个细胞培养室,以及连接小肠和肝细胞的培养液循环流动。
使用该平台共同培养肠和肝细胞,并投放已知可诱导NAFLD的游离脂肪酸(FFA:Free Fatty Acid),能够成功诱导出代表初期和进行性NAFLD的细胞状态(细胞内脂质贮存等)。此外,结合mRNA测序和显微成像进行单细胞分析,还可以研究NAFLD状态下与独特的细胞表型变化相关的基因网络。
在游离脂肪酸处理的有无、单培养和共培养等共计4种条件下,研究团队确定了存在基因表达差异的654个基因(小肠细胞)和1330个基因(肝细胞)。证实小肠细胞和肝细胞的共同培养降低了游离脂肪酸对基因表达的调节。
与单独培养的传统细胞培养实验法相比,通过使用该平台,新发现了小肠细胞和肝细胞对游离脂肪酸能够起到相互保护的作用。
龟井客座副教授表示,“目前,我们正在与制药公司进行联合研究,以确定可以在多大程度上模拟何种类型的病状。使用组织模式芯片,即使在前临床和疾病模型研究中不使用动物,也能更高效地研制药物。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Communications Biology
文章:Integrated gut–liver-on-a-chip platform as an in vitro human model of non-alcoholic fatty liver disease
DOI:10.1038/s42003-023-04710-8













