目前,将mRNA应用于疫苗以外的医药品的研发在全球范围内取得了进展,但mRNA在细胞内不稳定状态则是一大难题。京都大学iPS细胞研究所(CiRA)龟田重贤博士生和齐藤博英教授等人组成的研究团队,通过检测微RNA(miRNA)及RNA结合蛋白,开发出了可以根据细胞种类,控制基因表达的2种环状RNA开关,而且包含该开关的人造环形RNA可以稳定、持续地进行基因诱导。齐藤教授表示:“希望通过组合开关技术及环状RNA技术,实现选择性去除或再生目标细胞的mRNA药品。”上述成果已于1月16日刊登在Nucleic Acids Research上。

齐藤博英教授(左)和龟田重贤博士生(右)(供图:京都大学iPS细胞研究所)
使用了人工mRNA的基因导入技术,由于基因组损伤风险低,导入效率高,并且在理论上可以搭载任何蛋白质,所以不仅是疫苗,还可以应用于基因治疗、基因组编辑医疗等用途。但是,由于mRNA在细胞内不稳定,导致基因表达的持续性低、并且出现在目标细胞与组织之外的基因表达也成为了课题。
研究团队关注到的是环状RNA。龟田博士生表示:“在使用小鼠的基因补充疗法研究中,mRNA被分解,需要多次投放,副作用也很大,避免这些问题是我们开始该研究的初衷。”
一般的RNA会从末端开始分解,但环状RNA的末端是封闭的,因此在生物体内难以分解,基因表达易于持续。然而,迄今为止还没有控制环状RNA蛋白表达的技术。
在生物体内,miRNA会切断拥有互补序列的mRNA,抑制基因表达,并与RNA结合蛋白(RBP)转录的RNA相结合,来控制功能。二者都因细胞种类而异,并与环状RNA和mRNA相互作用。对此,研究团队认为,通过模仿、改变这种相互作用的机制,也许可以控制来自环状RNA的基因表达,并为此设计了环状RNA。
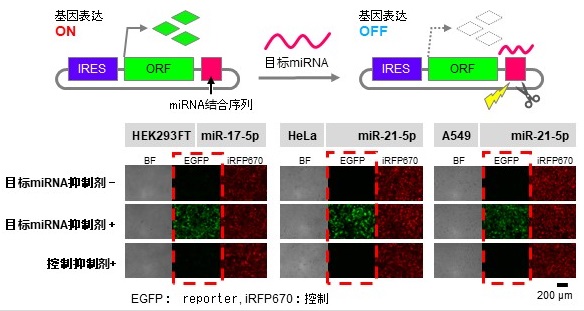
图1 miRNA应答开关的结构及在培养细胞中的基因表达(供图:京都大学iPS细胞研究所)
具体做法如下,首先在编码基因的区域上游,将拥有无Cap结构也能诱导翻译的内部核糖体侵入部位(IRES)的RNA,合成为环状。然后,合成响应细胞内miRNA、控制基因表达的环状RNA,并且仅在特定miRNA存在于细胞内时,才抑制基因表达。还通过在环状RNA的基因表达所必须的IRES序列中,插入识别RBP的序列,从而实现了RBP对基因表达的抑制。也就是说,构筑了两个闭合开关。研究团队还成功构建了结合这两个环形RNA开关的人工基因回路,并成功在miRNA存在的条件下激活了基因表达。
导通回路的输出根据目标miRNA的量而增加,具有比普通mRNA回路更好的基因表达持续性,在本次实验中确认持续性高达92倍。
使用本研究开发的系统,可以在只有目标miRNA的细胞中关闭基因表达,在没有目标miRNA和RBP时可以打开基因表达,甚至在只有目标RBP的细胞中也可以打开基因表达。如果将其应用于医疗,则可以在各种细胞中,选择性去除导致疾病的癌细胞等有害细胞,或只向特定的细胞传送基因,使出现异常的细胞变为正常细胞。
齐藤教授表示:“此次研究,为mRNA的新医药应用开发了基础技术。全球对环状RNA的期待很高,研究开发的竞争逐渐激烈。我们也成立了生物初创企业,今后,包括实用化课题之一的DDS在内,将与不同的公司及大学等合作共同推进研发。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Nucleic Acids Research
论文:Synthetic circular RNA switches and circuits that control protein expression in mammalian cells
DOI: 10.1093/nar/gkac1252













