近日,有一项标志着利用RNA干扰的核酸医药向前迈进一大步的研究结果被发布。岐阜大学研究生院联合创药医疗信息研究科的特任助教杉户信彦、特任教授赤尾幸博等人组成的研究团队,详细阐明了在大肠癌、胰腺癌中高频度变异的RAS细胞代谢网络机制,在全球首次成功开发了阻碍RAS变异的微小核糖核酸医药原料。赤尾特任教授表示:“ 经过20年左右的RAS研究,终于到达了开发药物种子的状态。目前,我们正与日本国内制药公司共同推进有关DDS的研究,希望能在向癌细胞输送药物有了眉目的时候验证其效果,开始临床研究。”相关研究成果已经刊发在《Molecular Therapy-Nucleic Acids》杂志电子版上。
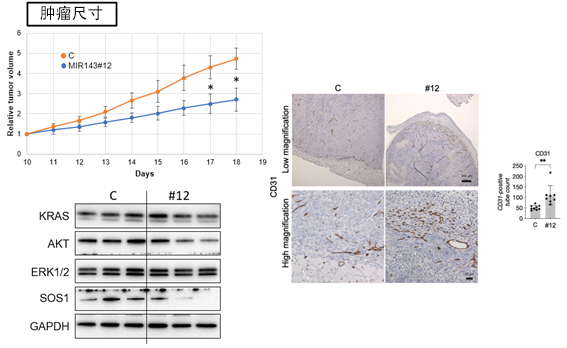
图1 miR-143#12在小鼠模型中的抗肿瘤效果
(左上)确认了miR-143#12给药后肿瘤尺寸的时间变化,发现与对照组相比,miR-143#12给药组中肿瘤的增大得到了抑制。(左下)在肿瘤样本中确认与RAS细胞代谢网络相关的蛋白质的量后,发现在miR-143#12给药组中的表达受到了抑制。(右)通过CD31染色,确认了miR-143#12给药组中的血管新生。
迄今为止的癌症基因组分析显示,约30%的人类癌症中存在RAS基因的变异。特别是在大肠癌中存在变异的比例约为40%,胰腺癌则高达约90%,从而加剧了恶性化的程度。RAS通过控制超过10个下游信号形成庞大的细胞代谢网络。尤其是其中的PI3K/AKT和MAPK/ERK信号,是诱导与细胞增殖、存活相关基因转录的重要信号传导路径。
RAS抑制剂的开发在全球范围内已进行了30多年。近年来,终于有一种仅对RAS的一种变异有效的化合物被批准成为医药品,但有报告称,在临床试验阶段已有约五成患者对其产生了耐药性。
赤尾特任教授于2006年开始研究全面抑制RAS和RAS细胞代谢网络的微小核糖核酸(miRNA)。结果表明,使RAS系统失效的主要miRNA是miR143。miR143是一种在许多癌症组织中的表达较正常组织要低的癌症抑制miRNA。miR143通过RNA干扰,不仅以RAS为靶点,还以诱导RAS下游细胞增殖的信号系统PI3K/AKT、MAPK/ERK的AKT和ERK为靶点,具有对这些信号相互抑制的作用。然而,市售的miR143活性较弱。
杉户特任助教和赤尾特任教授等人制备了约120种由氟、磷等进行化学修饰的miR143衍生物,从中发现了活性高且具有核酸酶耐药性的衍生物miR143#12。
细胞水平实验表明,#12以RAS细胞代谢网络的关键分子KRAS、SOS1、AKT、ERK为靶点,通过抑制整个系统发挥了较强的抗癌活性。此外,研究还发现,即使单独抑制各关键分子,RAS细胞代谢网络的反馈系统也会运作,产生变异,变异细胞会增殖,从而使#12获得耐药性。
研究人员将人类大肠癌细胞注入小鼠皮下,在第10天后,以160μg/kg的#12对其进行少量皮下注射,结果表明#12具有高抗癌活性,且几乎未见其对正常细胞产生影响。此过程中还确认了大肠癌中的血管新生。对此,赤尾教授表示:“大肠癌细胞是在氧气浓度低的地方生长的,因此有可能是血管新生破坏了恒常性,从而产生了高抗癌活性。”
微小核糖核酸在生物体内很快就会被分解,因此开发新药需要开发DDS。赤尾表示:“我们正在与制药企业共同研究、寻求对策,同时推进另一种方法,正在开发不被分解的构造。”
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Molecular Therapy – Nucleic Acids
论文:Chemically-modified MIR143-3p exhibited anti-cancer effects by impairing the RAS network in colorectal cancer cells
作者:Sugito, N., K. Heishima and Y. Akao
DOI:10.1016/j.omtn.2022.09.001
URL:sciencedirect.com/science/article/pii/S2162253122002396













