东京慈惠会医科大学生物化学讲座的山田幸司讲师与该校内科学讲座(消化器官、肝脏内科)的及川恒一讲师等人组成的研究团队,宣布发现了一部分细胞质蛋白质从肝癌细胞的内质网释放到了细胞外部的新型分泌机制,其中一部分血清中的“蛋白激酶C Delta(PKCδ)”可作为早期诊断得生物标志物。经过全面的蛋白质组学解析,研究团队发现分泌的细胞质蛋白质局限在内质网内,明确了其与内质网内膜分子相互作用后分泌到细胞外的机制。这一现象有望成为与肝癌发病机制和早期诊断相关的研究成果。相关研究成果刊登在了国际科学杂志《PNAS》8月31日号和《Gastro Hep Advances》8月4日号上。
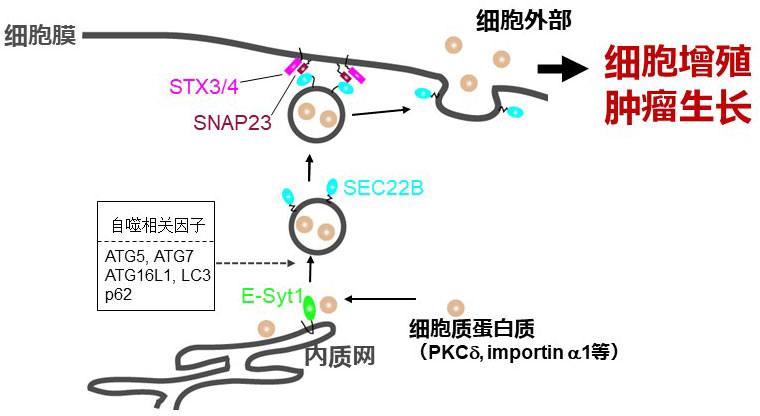
图1. 研究概要(供图:东京慈惠会医科大学)
①部分细胞质蛋白质通过与内质网膜蛋白E-Syt1的相互作用而局限在内质网内。
②依赖于自噬因子被送入到SEC22B阳性囊泡内。
③通过作为细胞膜SNARE的SNAP23、STX3、STX4从细胞膜释放到细胞外部。
在日本,肝癌是一种每年约有3.8万人罹患, 其中2.5万人死亡的疾病,病症难以显现,且随着病情的进展愈后也不佳。已知会经过慢性肝炎、非酒精性脂肪肝、肝硬化等阶段而发病,但与其他癌症一样,致癌机制尚不清楚。
在此之前,研究团队已发现,在正常细胞中核转运因子importin1和PKCδ等蛋白质停留于细胞内,而在肝癌细胞中则特异性地分泌到了细胞外,同时还明确了这些蛋白质具有细胞增殖能力等事实。
此次研究团队以弄清楚该分泌机制为目的,着眼于PKCδ进行了全面的蛋白质组学分析。
分析结果显示,PKCδ通过与内质网膜蛋白E-Syt1的相互作用而停留于内质网。由于E-Syt1的表达抑制,停留出现减少,在不分泌importin1和PKCδ等物质的胃癌细胞中则不存在这样的停留。另外,PKCδ通过与E-Syt1的相互作用,被与自噬相关的囊泡(SEC22B)所吸收,并通过与细胞膜的SNARE蛋白质的相互作用被释放到细胞膜外部。
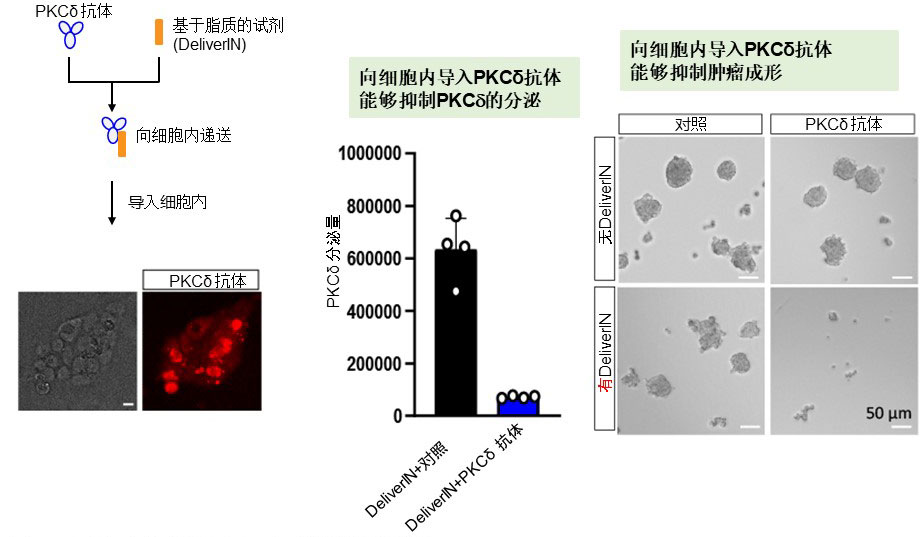
图2. 向细胞内导入抗体而产生的抗肿瘤作用(供图:东京慈惠会医科大学)
通过向细胞内递送PKCd抗体(左),抑制与E-Syt1的相互作用,PKCd的分泌也被抑制(中)。另外,3D球状细胞成形实验显示,细胞内递送能够明显抑制肿瘤的成形(右),这现象将成为新药的开发理论基础。
研究团队进一步将PKCδ抗体试剂递送到细胞内,调查了其对肿瘤形成能力的影响,发现该抗体抑制了肿瘤形成。表明了其具有作为新治疗靶标的可能性。
接下来,基于这些基础研究,以肝细胞癌患者血清中的PKCδ为对象,研究了其作为肝癌早期诊断的血液生物标志物使用的可能性。
首先,用夹心ELISA法检测了9例健康人和313例慢性肝病(包括182例各种阶段的肝癌)临床患者的血清,验证了其诊断能力,同时与现有的2种肝细胞癌标志物(AFP、PIVKA2)进行了比较。
结果显示,肝细胞癌组的血清PKCδ明显高于健康人和慢性肝病患者组。由此可知,血清PKCδ可以作为新的生物标志物来区分肝癌患者(以健康人为对照组)。另外,慢性肝病的血清PKCδ的肝细胞癌诊断能力与现有的标志物基本相同。
由于血清PKCδ和现有的各标志物没有关联性,因此组合使用这两种标记物可以提高诊断性能。现有2种标志物为阴性病例中的约半数可以通过血清PKCδ检测出阳性来。
此外,血清PKCδ与其他2种现有标志物不同,20毫米以下的超早期肝癌的阳性率约为45%,高于现有标志物(各约为15%),展现出了可用于以往难以实现的早期诊断的可能性。
研究团队今后将在推进诊断试剂盒开发的同时,对血清PKCδ与患者的临床医学特征的关联性进行解析,并以多设施共同研究的形式开展实用性验证。
原文:《科学新闻》
翻译:JST客观日本编辑部
【论文信息】
杂志:Gastro Hep Advances
论文:PKCδ Is a Novel Biomarker for Hepatocellular Carcinoma
URL:ghadvances.org/article/S2772-5723(22)00134-0/fulltext













