日本东北大学研究生院药学研究科的中林孝和教授、田原进也助教及研究生山崎公介等人组成的研究团队,明确了与肌萎缩性侧索硬化症(ALS)发病有关的SOD1毒性是如何在分子层面获得的新分子机理。
ALS是一种进行性神经退行性疾病,发病原因不明,所以治疗方法始终没有进展。虽然研究人员在ALS的病变部位发现了SOD1(铜离子与锌离子相结合的金属蛋白)聚集物,但SOD1毒性与ALS发病之间的关系,此前一直不清楚其详细机理。
此前研究团队证明,当SOD1的结构发生变化时,不但没有抗氧化作用,反而是具有氧化周围化合物的高毒性氧化作用,对此现象,研究人员研究了其氧化机理。此次首次成功证明,SOD1的抗氧化作用和氧化作用这两种完全相反的功能是通过SOD1内的单个硫-硫键(二硫键)的生成和断裂来转换抗氧化和氧化作用的。
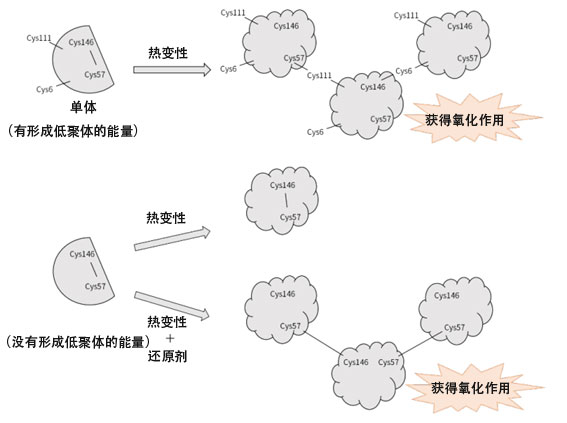
图1:随着SOD1低聚体化发生的分子内二硫键的断裂及获得氧化作用的模式图。随着形成低聚体,分子内二硫键断裂,获得氧化作用(供图:东北大学研究生院药学研究科中林孝和教授)
SOD1表达细胞毒性与SOD1聚集体无关,而是与数个SOD1分子聚集形成的低聚体有关。研究团队发现,硫-硫键断裂会形成低聚体,这种低聚体具有强氧化作用。由此提出了SOD1低聚体的毒性源自氧化作用的观点。
为验证这一点,研究团队准备了具有低聚体形成能力的突变体和不具备这种能力的突变体。SOD1通过半胱氨酸残基(Cys)之间的分子间二硫键形成低聚体。SOD1有4个Cys,Cys6和Cys111作为还原型游离硫醇基(-SH基)存在,Cys57和Cys146在分子内形成二硫键。
研究团队针对Cys6和Cys111置换了游离Cys,消除了分子间的二硫键形成能力,制备了不会形成低聚体的突变体。利用形成低聚体的普通SOD1和不会形成低聚体的突变体,研究了热变性引起的低聚体化与氧化作用的关系。利用DCF荧光法对热变性之前和之后的氧化作用进行量化发现,具有低聚体形成能力的普通SOD1发生热变性后,观测到了低聚体的形成和氧化作用的增大。而置换了游离Cys的突变体不仅没有观测到低聚体的形成,也没有发生氧化作用。
这些结果表明,低聚体的毒性是形成低聚体时分子内二硫键断裂引起的氧化作用所致。获得氧化作用不需要热变性和形成低聚体,仅通过切断分子内的二硫键即可获得。此次研究发现,仅仅是分子内的二硫键断裂,SOD1的酶活性就会从保护身体的抗氧化作用转变成有毒的氧化作用。
中林教授表示:“此次的研究表明,SOD1的分子内二硫键断裂会将酶活性由抗氧化作用转变为氧化作用。通过靶向分子内二硫键,有望从基础科学方面开发应用于治疗和预防的药物。”
【词注】
■DCF荧光法:利用二氯荧光素(DCF)分子的荧光强度评估活性氧生成量的方法。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Scientific Reports
论文:SOD1 gains pro-oxidant activity upon aberrant oligomerization: change in enzymatic activity by intramolecular disulfide bond cleavage
DOI:10.1038/s41598-022-15701-w













