日本名古屋大学研究生院工学研究科的清中茂树教授、京都大学研究生院工学研究科的浜地格教授及庆应义塾大学医学部的柚崎通介教授等人组成的研究团队宣布,开发出了可以选择性激活谷氨酸受体的“配位化学遗传学方法”,通过向支持运动功能和运动学习的小脑神经网络中发挥作用的代谢型谷氨酸受体1型(mGlu1)导入突变,可以在保留对原始配体谷氨酸的反应功能的同时,对人工配体做出反应后被激活。该成果有助于明确各种神经细胞的功能,并开发与神经活动异常有关的疾病的治疗方法。相关内容已经发布在国际科学期刊《Nature Communications》的6月16日号上。
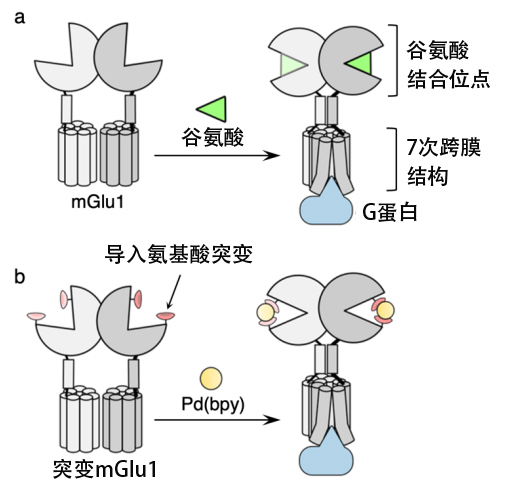
图1:通过配位化学遗传学方法激活mGlu1。(a)mGlu1的结构以及通过谷氨酸结合进行激活的模式图,(b)通过配位化学遗传学方法激活mGlu1的模式图(供图:名古屋大学)
脑内的大量神经细胞错综复杂地连接在一起,形成神经网络,从而实现高级的脑功能。研究人员认为,要了解脑功能,就需要明确各种神经细胞的功能,尽管脑内不同类型的神经细胞功能各不相同,但都是通过多个共同的受体来传递信息的。因此,即使使用针对各种受体的激活剂等,也很难明确每种受体的功能。
对此,研究人员近年来开发了选择性激活靶细胞类型的光遗传学和化学遗传学等方法,但这些方法都是通过强制表达人工蛋白质来控制细胞活性,因此无法分析脑内的实际神经传递。光遗传学可以通过基因导入光响应蛋白,利用光来操控细胞活性,但需要向脑内物理植入光纤,侵袭性较高,而且不能应用于脑深处光无法到达的细胞。此外,化学遗传学可通过在细胞中表达用不作用于体内蛋白质的人工配体选择性激活的人工受体来操控细胞活性,但受体的位置与原来不同。
为此,研究团队此次着眼于负责运动功能和运动学习、主要在小脑的多种神经细胞中丰富表达的mGlu1。为明确每种细胞的功能,研究了用人工配体选择性激活mGlu1的方法,即“配位化学遗传学方法”。
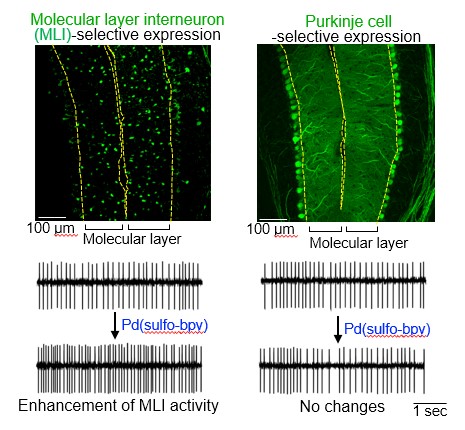
图2:通过配位化学遗传学方法进行细胞选择性的mGlu1激活。(上图)利用腺相关病毒确认MLI及浦肯野细胞选择性基因表达(通过绿色荧光蛋白确认),(下图)MLI的自发神经活动。利用Pd(sulfo-bpy)激活MLI的mGlu1时,确认神经活动增加。(供图:名古屋大学)
研究发现,mGlu1在细胞外有谷氨酸结合位点,谷氨酸(天然配体)结合通过该位点的结构变化将信息传递到细胞内。
因此,为通过人工配体结合引起这种结构变化,研究团队在谷氨酸结合位点导入突变,探索了与之匹配的人工配体。具体来说,在谷氨酸结合位点的入口处导入组氨酸(金属配位氨基酸)突变,发现了与之匹配的人工配体钯联吡啶络合物(Pd(bpy))。向突变mGlu1施用人工配体确认,可以在维持常规谷氨酸反应的同时,对人工配体也做出了反应。
研究团队还进一步评估了人工配体的细胞毒性,设计了不影响细胞增殖和神经突起延伸的人工配体Pd(sulfo-bpy)。
研究团队通过基因组编辑(CRISPR/Cas9)将这种突变导入小鼠体内确认,小鼠的运动和其他功能都显示正常。
向相同小鼠的小脑切片中添加Pd(sulfo-bpy)后,观察到了通常由mGlu1的激活引起的小脑长期抑制(突触电流反应持续减弱),而为野生小鼠添加该人工配体则未观察到这种现象。
在小脑中,mGlu1不仅在浦肯野细胞中表达,还在调节浦肯野细胞功能的颗粒细胞及分子层中间神经(MLI)中也有表达。关于MLI此前有报告显示,向小脑切片施用mGlu1激活剂(DHPG)会增强神经活动,但一直不清楚这种增强对哪种神经细胞的激活比较重要。
对此,研究团队此次利用新开发的方法,通过腺相关病毒和细胞类型选择性基因表达启动子在小鼠脑内的浦肯野细胞和MLI中分别表达了突变mGlu1。然后向这些小鼠的小脑切片施用Pd(sulfo-bpy)。
结果显示,神经活动在MLI中增强,但在浦肯野细胞中没有增强,由此首次确认,MLI的活动增强依赖于MLI中表达的mGlu1的激活。
该方法被认为不仅适用于mGlu1,也适用于其他谷氨酸受体,还有望加速阐明与谷氨酸受体有关的记忆和学习等高级脑功能,并作为由这些受体异常引起的神经疾病的治疗方法使用。
清中教授表示:“mGlu1被认为对运动学习非常重要。今后将为在浦肯野细胞中表达突变mGlu1的小鼠添加人工配体,观察小鼠的行为会出现什么样的表型,以及运动学习能力是否会得到改善。了解哪些大脑回路在控制人类的行为是新一代神经科学的研究范畴。”
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Nature Communications
论文:Coordination chemogenetics for activation of GPCR-type glutamate receptors in brain tissue
DOI:10.1038/s41467-022-30828-0













