日本量子科学技术研究开发机构(QST)量子生命和医学部门量子医科学研究所脑功能成像研究部的佐原成彦组长和小野麻衣子研究员等人组成的研究团队宣布,与顺天堂大学和长崎大学等共同发现,自噬受体蛋白“p62”介导的自噬会通过分解被视为痴呆症病因的Tau蛋白聚集体中毒性尤高的Tau低聚体来抑制痴呆症病症。“p62”缺损的痴呆症模型小鼠在与记忆有关的海马体中观察到明显的Tau低聚体积累、脑萎缩和炎症增加。该成果有助于开发痴呆症的治疗方法。相关内容已经发布在国际科学期刊《Aging Cell》6月5日号上。
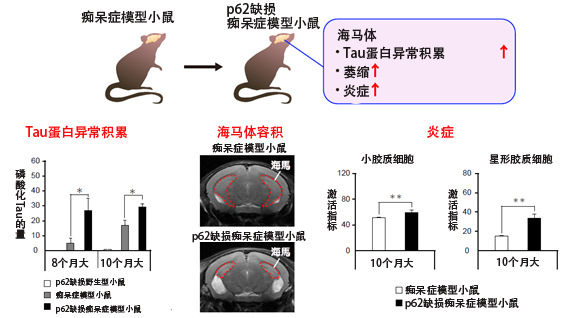
图:在p62缺损的痴呆症模型小鼠海马体内观察到Tau蛋白异常积累、萎缩和炎症的增加(供图:量子科学技术研究开发机构)
痴呆症患病率随着年龄的增长而增加,因此在超老龄化社会的日本已成为一个社会问题。在阿尔茨海默病等痴呆症中,异常的Tau蛋白聚集体会在大脑的神经细胞和胶质细胞中累积,研究认为,这种累积过程中会损伤神经细胞,导致细胞死亡。
大脑的稳态本来是依靠分解细胞内的无用蛋白质及其聚集体的泛素-蛋白酶体和自噬两种分解系统来维持的。近年来有报告指出,自噬分为选择性自噬和非选择性自噬,选择性自噬参与蛋白质聚集体的分解。
在多种类型的自噬受体蛋白中,研究人员观察到“p62”会沉积在神经退行性疾病大脑特有的Tau病变中,说明可能参与了Tau病变(神经原纤维缠结)的分解,但一直不了解详细情况。神经原纤维缠结是在阿尔茨海默病患者的脑神经细胞中发生的病变,异常磷酸化的Tau蛋白聚集体通过在神经细胞质中纤维化并沉积,使得Tau蛋白随着结构的变化而聚集在脑细胞中的。
研究团队此次制作了异常Tau蛋白在脑神经细胞中积累的痴呆症模型小鼠,调查了“p62”缺损的影响。通常野生小鼠的寿命只有2年左右,不会出现痴呆症。
在痴呆症模型小鼠(PS19小鼠)中,异常Tau蛋白随着年龄的增长在海马体中积累,导致神经细胞逐渐死亡,海马体萎缩。在“p62”缺损痴呆症模型小鼠中,磷酸化的异常Tau蛋白在海马体中的积累从早期就显著增加。研究团队利用MRI测量海马体的容积发现,萎缩速度明显加快。另外,控制脑内免疫的小胶质细胞和星形胶质细胞在海马体中被激活,炎症加剧。
此外,研究团队还详细分析了“p62”缺损痴呆症模型小鼠海马体中不断增加的Tau聚集体的类型,发现高度纤维化的Tau聚集体呈增加趋势。另外还发现,Tau低聚体的积累与痴呆症小鼠相比显著增加。Tau低聚体是异常磷酸化的Tau蛋白少量结合的聚合物,毒性被认为尤其高。而在野生型小鼠中,即使是高龄小鼠也未观察到Tau低聚体的积累,“p62”缺损小鼠同样未观察到。
虽然自噬受体蛋白有很多种,但“p62”在大脑中的表达量尤其多,因此将“p62”作为新药开发的靶点备受期待。
对此,进行联合研究的长崎大学的松本弦讲师已经建立激活“p62”的化合物筛选系统。
今后将验证利用该筛选系统探索得到的化合物的效果。另外还将同时推进明确原本负责微管的聚合和稳定化的Tau蛋白是在什么因素的触发下变成高毒性Tau低聚体的。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:Aging Cell
论文:Central role for p62/SQSTM1 in the elimination of toxic tau species in a mouse model of tauopathy
DOI:doi.org/10.1111/acel.13615













