日本理化学研究所环境资源科学研究中心天然物生物合成研究组的组长高桥俊二和特别研究员Nhu Ngoc Quynh Vo,与技术基础部门生命分子解析组的特别研究员野村勇太(当时,现为埼玉大学助教)等人组成的研究团队,利用细菌的蛋白质数据库探索了生成类萜的酶基因,发现了可以从法尼基焦磷酸(FPP)中有效生成Drimenol(双环倍半萜)的海洋细菌源新倍半萜合酶。
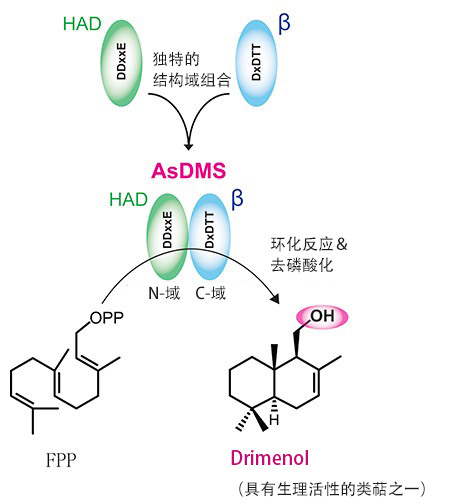
图:源自海洋细菌的新Drimenol合酶的结构域
源自Aquimarina spongiae的DMS(AsDMS)具有利用N-域的DDxxE模体和C-域的DxDTT模体催化法尼基焦磷酸(FPP)生成Drimenol的环化反应和去磷酸化反应的活性。AsDMS是在进化过程中卤酸脱卤酶(HAD)样水解酶结构域与萜烯合酶的β结构域融合形成的新型酶。(供图:理化学研究所)
研究团队以从丝状真菌米曲霉(Aspergillus oryzae)中获得的倍半萜合酶(AstC)的氨基酸序列为基础,从细菌的蛋白质数据库中探索了类似的酶基因。另外,还通过氨基酸序列分析,选出了六个保留萜烯合酶共有的重要模体DDxxE和DxDTT的候选酶基因。
为分析这些酶基因的功能,研究团队利用人工合成DNA制备了表达载体,在大肠杆菌中表达了酶。利用纯化酶和多种基质分析反应发现,有五种酶是能从法尼基焦磷酸(FPP)中生成Drimenol的Drimenol合酶(DMS)。其中,源自海洋细菌Aquimarina spongiae的DMS(AsDMS)与源自植物的DMS相比表现出更高的催化活性。这个结果表明,此次发现的酶中,AsDMS是最适合以低成本快速生产Drimenol的酶。
此外,研究团队搭建AsDMS的结构模型发现,基质(FPP)与酶的N端和C端的蛋白质结构空间结合。为验证负责催化活性的必备区域,制备了在推测存在于活性中心的氨基酸中导入位点特异突变的酶,分析了反应。分解结果表明,这种酶由DDxxE和DxDTT两个模体构成活性中心,参与通过从FPP环化为Drimenyl Pyrophosphate(中间体)和从Drimenyl Pyrophosphate中去磷酸来生成Drimenol的连续反应。
另外,为调查AsDMS各个结构域的进化起源,还分析了系统发生树。根据结果预测,AsDMS由卤酸脱卤酶(HAD)样水解酶和萜烯合酶β进化而来,是这两个功能域融合形成的新萜烯合酶。
高桥组长表示:“此次研究中发现的AsDMS是由从不同酶起源进化而来的卤酸脱卤酶样水解酶区域和萜烯合酶β区域构成的新型酶。今后通过进一步进行基因组探索研究,有望发现具有新功能的类萜合酶。”
【词注】
■类萜、倍半萜:类萜是以5碳异戊二烯为构成单位的天然有机化合物的总称,也称为萜烯。作为药品、农药、抗菌剂、香料和食品添加剂使用。倍半萜是从3个异戊二烯相连形成的15碳法尼基焦磷酸(FPP)衍生而来的化合物,根据环化方式的不同存在多种结构。
■模体:对酶促反应非常重要的氨基酸序列,在具有相似功能的酶之间保留的区域。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部
【论文信息】
期刊:ACS Chemical Biology
论文:Identification and Characterization of Bifunctional Drimenol Synthases of Marine Bacterial Origin
DOI:10.1021/acschembio.2c00163













