【导读】以光合作用为首,植物具备有效生成有用物质的机制。近年来,尝试将植物的这种特性应用于产业领域的研究非常活跃。其中,着眼于细胞内小器官“细胞器”研究的是领导ERATO“沼田细胞器反应簇项目”的京都大学研究生院工学研究科教授沼田圭司。其研究目标是通过确立能自由控制细胞器的技术,培育出具有最适合物质生产机能的植物,从而在以植物为起点的各行各业实现创新。

沼田圭司
京都大学研究生院工学研究科教授
理化学研究所生物高分子研究团队组长
2016年起担任ERATO研究总负责人
比编辑基因组更容易
目标是高功能新物质的生产
为削减二氧化碳和解决能源问题,近年来,利用生物的物质生产受到了广泛关注。以光合作用为代表,植物可以有效生成有用的物质,这种机理不仅限于食物和能源,如果还能将其应用于材料和药品等的生产,就有望解决各种社会课题。然而,生物的物质生产机理非常复杂,人类尚未从根本上解明这些机理。因此,现阶段还无法自由设计适合生产所需物质的最佳生物。
领导ERATO“沼田细胞器反应簇项目”的京都大学研究生院工学研究科教授、理化学研究所环境资源科学研究中心生物高分子研究团队的沼田圭司组长还是研究利用生物生产物质的科研人员之一。沼田在博士课程期间学习了高分子晶体结构分析后赴美留学,留学期间研究了作为再生医疗和生物材料使用的丝蛋白中所含的β折叠结构的毒性评估,以及向细胞内输送目标分子的方法等课题。他回忆当时的情况说:“研究的重点放在了高分子科学上,同时学习了如何操作细胞和导入各种物质。”
回国后,沼田开始在理化学研究所从事研究如何使植物细胞产生生物塑料的一种——聚羟基链烷酸。然而,即使修饰核DNA,也无法获得所期待的产量。调查原因后发现,是因为来自细胞器之一的线粒体的物质不足。沼田说:“无论对核DNA进行多少操作,如果不增强细胞器的功能,就很难真正大量生成生物所需的物质,所以我们认为,需要在输送基因修饰分子的对象中增加细胞器。”
在此之前,细胞器的修饰尚无方便易用的方法,研究也不够充分,所以必须开发,细胞器的修饰方法。另一方面,沼田表示DNA修饰也需要新的方法:“核DNA的修饰开始广泛使用CRISPR-Cas9等基因组编辑技术。但植物细胞利用CRISPR-Cas9编辑核DNA之后,还需要从核DNA中清除Cas9基因。所以我认为还需要开发一种更简便的方法。”
沼田表示研究的最终目标是利用植物生产高功能的新物质,由此创造出新材料。他认为仅单独确立核DNA和细胞器的修饰技术很难达成目标,于是新设定了一个更大的目标(图1)——通过细胞器的功能和相互作用明确与植物的物质生产所有相关的机理,并确立改良植物性状的基本技术,为此沼田成立了ERATO项目。
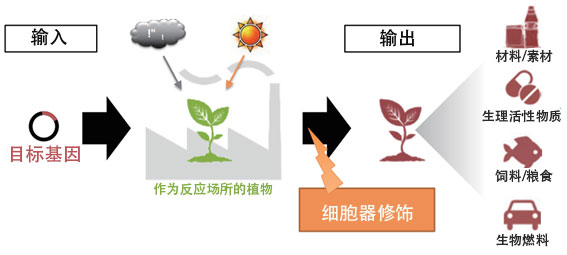
图1:利用植物细胞器的物质生产
人工创造细胞穿膜肽
在叶绿体和线粒体中导入DNA
ERATO最初组建了“融合肽设计组”、“细胞器修饰组”和“细胞器相互作用组”三个研究小组来推进研究。融合肽设计组负责利用高分子化学知识设计向细胞内运送分子的肽;细胞器修饰组利用获得的肽修饰核DNA和细胞器DNA;细胞器相互作用组利用各种装置确认基因的表达。目前,为与其他研究机构开展联合研究,又增加了由研究藻类和人体细胞的研究人员参加的“融合肽利用组”,目前共有四个小组在推进研究。
目前,沼田向植物线粒体中选择性导入DNA的研究已经获得成功,正在通过各种植物细胞探索能有效进入细胞的细胞穿膜肽(CPP,图2)。研究人员以动物细胞常用的肽为中心创建了由55种CPP构成的资源库,并利用烟草、拟南芥、番茄、白杨和水稻等植物,评估了导入效率和导入方式。研究结果表明,CPP的导入效率和定位因植物种和组织而异,另外还确定了多种对所有植物种都有效的CPP。
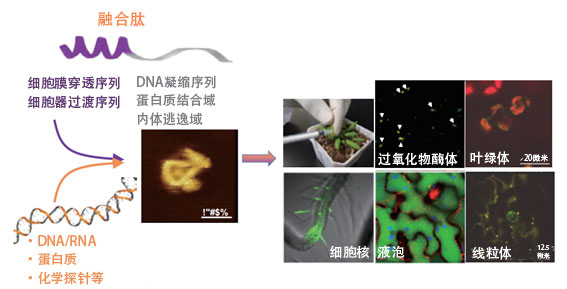
图2:利用肽的各种功能,将目标物质输送到植物中的特定位置。
接下来,沼田根据取得的研究结果尝试向植物和藻类的色素体中导入了DNA。制作了想输送至色素体中的环状质粒DNA、含有促进叶绿体吸收的叶绿体过渡序列肽、以及在带正电的肽复合体中添加CPP的团簇,然后注入模型植物拟南芥的叶子中。由此DNA按预期被成功地导入了叶绿体中(图3)。
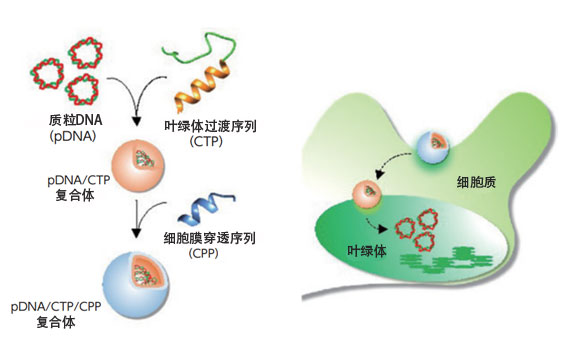
图3:通过将质粒DNA与含叶绿体过渡序列的肽复合化,并添加含CPP的肽,形成了包含两种功能肽的团簇,然后成功地将其导入了植物内部的色素体中。
上述实验取得成功后,沼田又尝试利用同样的方法分别向存在于烟叶叶绿体、番茄果实和土豆根茎中的色素体有色体及淀粉体中导入DNA,虽然效率和导入时间上存在差异,但所有实验均取得了成功,并确认导入的DNA获得了正常表达(图4)。沼田说,虽然如愿实现了目标技术之一,但还存在有待解决课题。他介绍说:“这项实验使用的CPP和复合体的导入效率较低。如果我们想利用植物细胞来生产物质,则需要大幅提高导入效率”。为此,沼田开始致力于改良CPP。
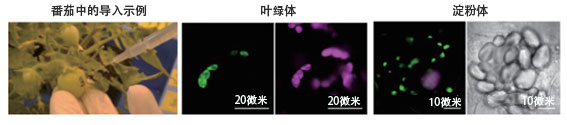
图4:左图是向番茄果实中导入肽和DNA簇的情景。中间两图为烟叶叶绿体的共聚焦激光显微镜图像,其中左侧绿色表示报告基因的表达,粉色为叶绿体。右侧两图为土豆根茎的淀粉体图像,其中左侧共聚焦激光显微镜图像中的粉色为报告基因的表达,绿色为叶绿素,右侧的明场图像显示的是无色淀粉体的聚集。
为探索效率更高的CPP,沼田尝试了以前报告的所有具备相似功能的肽,发现渗透性因对象细胞而异。因此,沼田通过添加天然不存在的人工氨基酸,成功提高了对肽分解酶更具稳定性的肽。
另外,导入细胞的方法决定着肽能否被运送至目标细胞器中。例如,细胞膜上形成凹陷,目标物质像被凹陷包围起来一样进入细胞内的内吞作用,如果是植物细胞,则肽被运送至液胞时,如果是动物细胞,则肽在被运送至溶酶体时,大部分的肽就都分解了。这种状态下,即使提高向细胞内运送分子的效率,肽也很难到达目标细胞器,并在那里发挥操作DNA的功能。
成功地直接导入蛋白质
利用人工肽效率提高20倍
沼田指出,这些课题并不只局限于植物。在开发向目标器官的细胞递送药物的纳米载体时,确立避免内吞作用的方法同样也是一个课题。“为实现有效的细胞膜穿透序列而合成各种人工功能肽时,发现了一种肽恰好能利用内吞作用以外的途径进入”,沼田满面笑容地说到。分析发现,这是一种通过诱导此前植物细胞未曾报告过的与巨胞饮作用的入胞机理相似的现象,而使得肽进入细胞的(图5)。
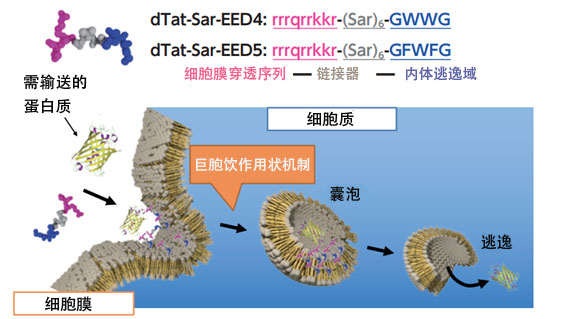
图5:巨胞饮作用是将细胞外的物质吸收到细胞内的一种机制,吸收过程会形成特征性的细胞膜突起结构和直径为200纳米(10亿分之1 米)以上的细胞内囊泡。
沼田还利用这样获得的功能肽(dTat-Sar-EED4),尝试向植物中直接导入了功能蛋白质——首先制备dTat-Sar-EED4与水解酶的复合体,确认能否导入烟草培养细胞和拟南芥子叶等模型植物中,最终利用荧光显微镜确认到了酶在细胞内的表达(图6)。沼田感觉良好地说:“经确认,与之前用于植物细胞的CPP相比,导入效率最大提高20倍。今后有望成为修饰细胞器的有力武器。”
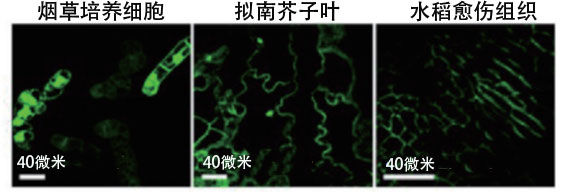
图6:在人工细胞穿膜肽(dTat-Sar-EED4)的作用下,水解酶β-葡萄糖醛酸苷酶(GUS)以活性状态分别被导入三种模型植物的荧光显微镜图像。
另一方面,简便修饰植物细胞核DNA的技术研究也取得了成果。沼田等人研究了将CRISPRCas9中可直接切断基因组的蛋白质Cas9直接导入细胞的技术。具体来说,利用可以封入蛋白质的纳米级胶囊,在其表面附着CPP后,导入了用拟南芥组织制备的未分化细胞块——愈伤组织中,确认可以有效进入细胞内,并成功地使目标基因发生了典型变异(图7)。

图7:将封在纳米胶囊中的Cas9 RNP递送至植物的愈伤组织细胞中,进行基因组编辑。
与嵌入CRISPR-Cas9所需的基因,并使其在细胞内部表达以修饰DNA的常规方法相比,上述方法不仅操作简单,还减少了破坏目标基因以外基因的脱靶现象。作为更安全的植物基因组编辑技术备受期待。另外,最新的研究还成功开发了通过喷雾将核酸导入植物中来修饰植物的更简单的方法(图8)。沼田说:“这些方法作为高度通用的安全基因组编辑技术,还能用于各种实用植物的品种改良。”
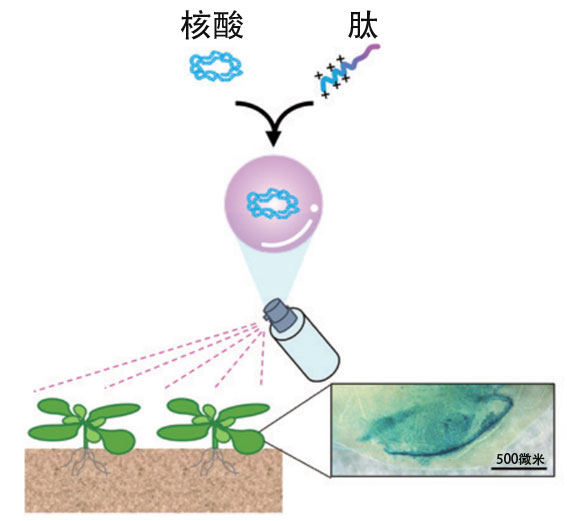
图8:向植物体喷洒核酸-肽复合体
着眼于产业应用的合成蛛丝
下一个课题将是解析相互作用
使用这些基础技术的应用研究也已开始。例如,利用光合细菌制造蛛丝的研究。蛛丝虽然非常轻,但其韧性可以与钢铁媲美,在需要耐强烈冲击的建筑结构材料方面的应用备受期待。然而,用于建筑结构材料的大量蛛丝很难仅通过饲养蜘蛛获得,目前正在开发向各种生物细胞导入基因进行大量生产的技术。
沼田等人还把棒络新妇蜘蛛蛛丝的主要成分MaSp1蛋白的基因导入到红色光合细菌中并成功进行了生产。将所获得的MaSp1在有机溶剂中延伸后,会形成与蛛丝非常相似的纤维,利用电子显微镜观察确认,从断裂面开始,内部形成了纤维结构(图9)。研究人员目前还在用9升的大型培养槽进行试验,如果能实现实用化,就有望在削减温室气体的同时合成有用的物质。
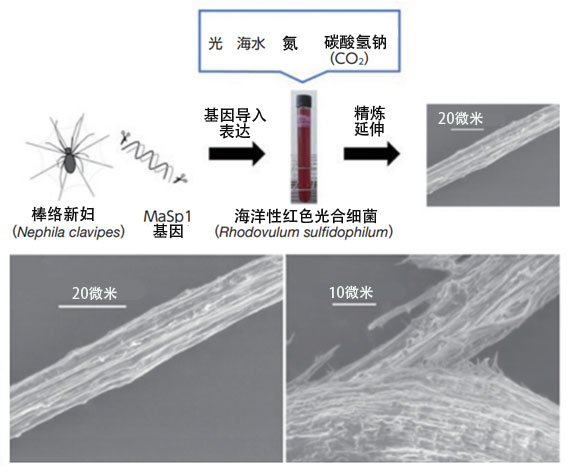
图9:在730纳米红外LED照射下,边向人工海水中添加作为碳源的碳酸氢钠和作为氮源的氮气,边培养海洋性红色光合细菌,获得了蛛丝。左下图是通过MaSp1蛋白获得的纤维扫描电子显微镜图像。右下图是纤维断裂面的扫描电子显微镜图像。
除此之外,利用培养细胞合成天然橡胶以及生产均质人工木材的研究也已开始。然而,进一步提高生产效率对于实际的工业应用至关重要。沼田就接下来的课题表示:“为此还需要明确细胞器之间的复杂相互作用。”
作为这方面的一个线索,沼田报告了线粒体随着与叶绿体的相互作用轻微摆动的现象(图10)。研究发现,在细胞内,不同性质的细胞器会相互作用,参与物质的代谢。如果能积累这些知识,提高各个细胞器的功能,并控制其相互作用,从而提高细胞的代谢能力,就一定可以向沼田描绘的未来迈出坚实的一步。
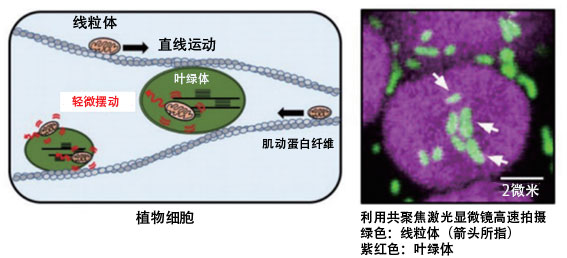
图10:拟南芥叶肉细胞中的线粒体运动示意图(左)及利用共聚焦激光显微镜高速拍摄的图像(右)。研究发现,不同于直线运动的轻微摆动与叶绿体的相互作用有关。
原文:JSTnews 3月号
翻译编辑:JST客观日本编辑部














