核心要点:
1. 表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)是EGFR突变阳性的非小细胞肺癌(NSCLC)的一线治疗药物,但是,EGFR-TKI对EGFR野生型的NSCLC效果不佳。
2. 研究人员设计了一种多功能的纳米药物,该纳米药物以四氧化三铁纳米颗粒(SPIO)为内核,同时负载厄洛替尼和贝伐单抗,实现了肿瘤内的选择性富集。
3. 该纳米药物在EGFR野生型的A549异种移植肿瘤小鼠模型中,成功抑制了肿瘤的生长,表明纳米药物逆转了A549肿瘤细胞对厄洛替尼的抗性。
4. 融合核磁共振成像技术,实现了对纳米药物瘤内富集的动态监测;并且对肿瘤组织内血管的形态和力学变化进行了观测。
国立研究开发法人量子科学技术研究开发机构量子生命・医学部门量子医科学研究所先进核医学基础研究部胡宽研究员,张明荣部长等人与中国暨南大学的研究人员合作,开发了一种新型的多功能纳米药物用于逆转表皮生长因子野生型非小细胞癌肺癌(EGFR-wt NSCLC)对酪氨酸激酶抑制剂(TKI)厄洛替尼的抗性,为具有野生型的EGFR非小细胞肺癌病人提供了一种潜在的治疗方式。该成果于近日发表在重要的生物材料期刊《Bioactive Materials》。
研究背景
原发性肺癌是世界范围内最常见的恶性肿瘤。从病理和治疗角度,肺癌大致可以分为非小细胞肺癌(non small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer, SCLC)两大类,其中非小细胞肺癌约占比80-85%,小细胞肺癌约占比15-20%。全球绝大多数国家,肺癌的发病率与死亡率均居首位。2018年全球新增肺癌患者209.4例,死亡176.1万例,分别占全部癌症发病与死亡的11.6%和18.4%。由此可见,开发针对肺癌的治疗药物迫在眉睫。
非小细胞肺癌的药物治疗包括化疗、分子靶向治疗以及免疫治疗。研究发现,非小细胞肺癌中存在一些基因的突变或者表达异常,从而导致了肿瘤的发生。根据NCCN指南推荐目前非小细胞肺癌相关的基因突变有:EGFR基因突变、ALK基因重排、ROS1基因重排、BRAF点突变、KRAS突变、Met外显子突变、RET重排、ERBB2基因突变等。根据这些基因的异常变化,针对非小细胞肺癌的分子靶向治疗药物相继被开发出来。
EGFR、ALK和ROS1是非小细胞肺癌最主要的驱动基因,也是最具临床价值的靶点,其中EGFR突变占比高,成药种类较多。目前研究表明,EGFR突变阳性的NSCLC, 应用EGFR-TKI单药治疗安全有效,其代表药物厄洛替尼已经成为EGFR突变阳性NSCLC的标准一线治疗方案,而对EGFR野生型的NSCLC,EGFR-TKI的治疗效果欠佳。因此,如何提高厄洛替尼在EGFR-WT的NSCLC中的有效率,是重要的医学问题。
研究内容
EGFR-TKI在EGFR野生型NSCLC中的疗效欠佳的机理尚不清楚。但是,科学家尝试了多种方式,来克服EGFR野生型NSCLC对TKI的抗性。比如科学家将组蛋白去乙酰化酶(HDAC)抑制剂Panobinostat或者自噬抑制剂Chloroquine 与厄洛替尼联合使用,成功逆转了EGFR-WT非小细胞肺癌对厄洛替尼的抗性。尽管这些方案取得了不错的效果,但是这些方案存在着不足,未来临床效果如何还有待进一步的检验。因此。开发新的可以逆转EGFR-WT非小细胞肺癌对厄洛替尼抗性的方案具有重要的科学意义和应用价值。
该项目中,研究人员制备了一种由磁性纳米颗粒四氧化三铁(SPIO)为内核的纳米药物,在SPIO的表面,由聚乙二醇-磷酸脂分子(DSPE-PEG2000-COOH)形成一层保护膜,由于厄洛替尼的疏水性,其可以嵌入纳米颗粒的疏水内部,在纳米颗粒的表面,进一步修饰了一种靶向血管表皮正常因子的单克隆抗体-贝伐单抗(Bevacizumab)。因此,该纳米药物具有多种功能:首先,选择性递送厄洛替尼到肿瘤部位;其次,贝伐单抗可以提高靶向递送的效率,而且促进肿瘤血管的正常化;SPIO是一种核磁共振成像试剂,通过监测SPIO的信号,可以实时追踪纳米药物在体内的动态(图1)。
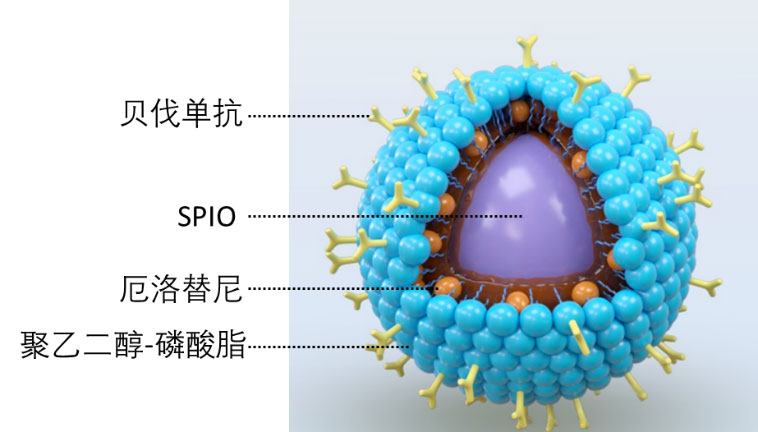
图1. 纳米药物的结构示意图。
研究人员首先表征了纳米药物的形貌和物化参数。结合TEM和动态光散射表征结果,得到纳米药物的平均尺寸为28.3 nm。该纳米药物具有良好的体外稳定性,在溶液中,表现出一定的表面负电势。随后研究人员对纳米药物的细胞毒性进行了研究。结果表明:与厄洛替尼单药相比,纳米药物对A549细胞的抑制效率显著提升。机理研究表明,纳米药物成功引起了细胞内活性氧(ROS)的产生,从而诱导了细胞的凋亡。
研究人员接下来通过核磁共振成像技术监测了纳米药物的瘤内富集效率。结果表明,表面修饰了贝伐单抗的纳米颗粒具有更高的瘤内富集效率。纳米药物在瘤内的富集在注射后12小时内达到峰值。随后,研究人员在移植了A549肿瘤细胞的小鼠模型体内,测试了纳米药物的治疗效果。不出所料,纳米药物完全逆转了小鼠肿瘤的生长(图2),且治疗过程中,小鼠未表现出明显的体重改变和血液指标的变化,表明纳米药物具有良好的体内安全性。
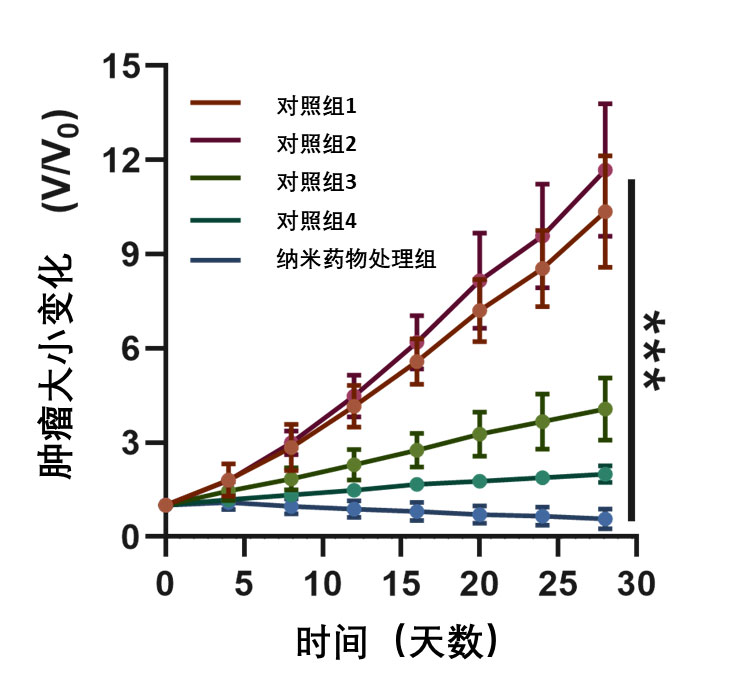
图2. 实验鼠肿瘤生长曲线。
为了详细了解贝伐单抗的作用,作者通过功能核磁共振成像技术和组织免疫染色手段对肿瘤血管的组织形态、标志物的表达等指标进行了表征。在治疗的终点,核磁共振成像显示纳米药物处理的小鼠具有最佳的肿瘤血管状态,并且血管内水分子扩散以及血液灌注的指标都是最好的,表明贝伐单抗促进了血管正常化,防止了乏氧的产生,增强了厄洛替尼的效果(图3)。
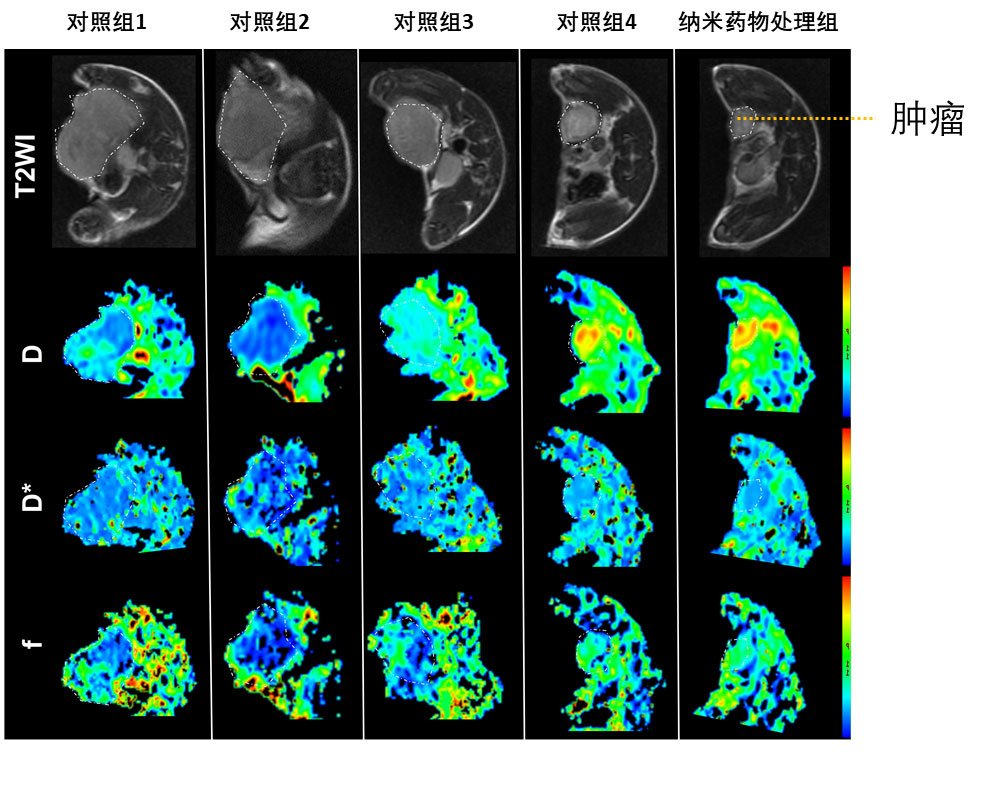
图3. 功能核磁成像结果。
研究结论
研究人员成功开发了一种多功能的、诊疗一体化的纳米药物,该纳米药物可以靶向递送厄洛替尼到达肿瘤部位,并且逆转EGFR野生型NSCLC对厄洛替尼的抗性。此外,纳米颗粒表面的贝伐单抗进一步提高了纳米药物的靶向递送效率,并促进了肿瘤血管正常化,提高了厄洛替尼的治疗效率。总之,该研究为EGFR野生型非小细胞肺癌提供了这一种全新的治疗方案,具有极高的临川转化价值。
论文信息
论文题目: A multifunctional nanotheranostic agent potentiates erlotinib to EGFR wild-type non-small cell lung cancer
刊载期刊 Bioactive Materials
论文链接:doi.org/10.1016/j.bioactmat.2021.10.046
文 胡宽
编辑修改 JST客观日本













