近畿大学生物理工学部的宫本圭副教授与剑桥大学的Christopher Penfold博士研究员等人组成的研究团队,开发出了诱导哺乳动物的基因组初始化重编程的新方法。通过修改克隆技术,全球首次成功地在野生环境中,从已灭绝的弯角剑羚的基因组中,在早期胚胎中诱导激活了特异性表达的基因。在以往的研究中,分析野生动物的基因组主要采用调查DNA碱基序列的方法,而利用此次开发的新方法,可以在包括灭绝动物在内的各种动物中分析基因组序列是如何工作的。相关研究成果已发布在iScience上。
(供图:近畿大学。Licensed under CC BY 4.0. https://doi.org/10.1016/j.isci.2021.103290)
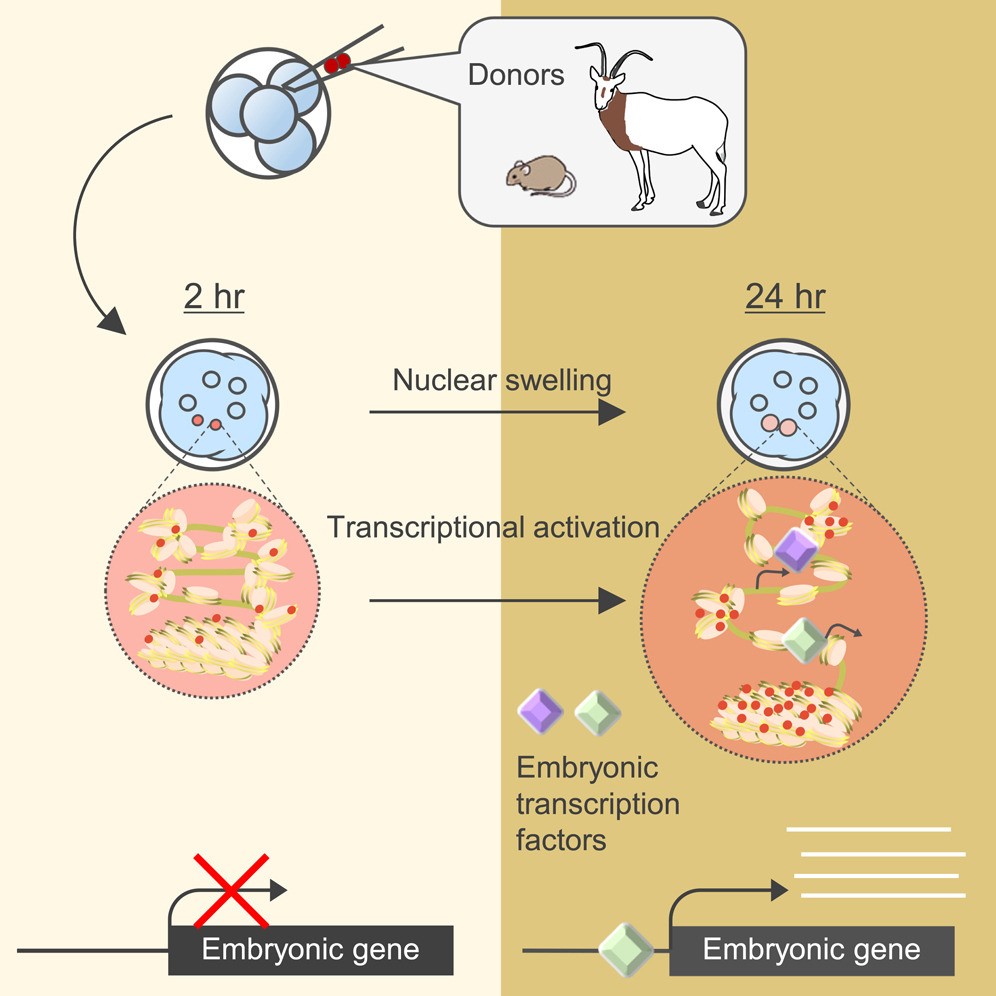
用于培育克隆动物的体细胞核移植需要使用带有待培育克隆动物基因组的供体细胞和移植供体细胞的同种受体卵细胞。也就是说,若要通过克隆技术重编程野生动物的细胞时,需要收集野生动物的卵子,这在现实中是很困难的。因此,研究人员开发了向与供体不同种的卵子中移植细胞核的种间核移植法,但在种间核移植中,很多时候种间克隆胚不能正常进行细胞分裂,也无法确认克隆胚发育所需的胚胎基因的激活,移植大多都以失败告终。
研究团队为了克服采用以往的核移植法时观察到的胚胎分裂异常和胚胎基因激活失败等主要障碍,旨在开发一种新型移植方法,可以直接诱导激活胚胎基因,而无需分裂。传统的核移植法在胚胎基因被诱导激活前,供体细胞的细胞周期与早期胚胎型同步,发生细胞分裂后基因才被激活,研究团队着眼于这一点,提出了向已经具有转录活性的早期胚胎中直接移植供体细胞核的新型核移植法。
研究团队首先利用这种新型核移植法移植了与早期胚胎同种的小鼠供体细胞,并证实激活了移植细胞原本没有表达的胚胎基因。另外还通过实验证明,无需细胞分裂和DNA复制即可诱导激活这种胚胎基因。利用哺乳动物的早期胚胎,在不进行分裂和DNA复制的情况下直接诱导激活基因尚属全球首次。此外,还成功确定了对激活胚胎基因至关重要的早期胚胎中存在的转录因子。
研究团队从野生环境中已经灭绝,目前仅在动物园中饲养的弯角剑羚衰老死亡后采集的组织中提取原代培养细胞,研究了能否利用该细胞核通过新型核移植法从异种细胞进行胚胎基因转移。结果显示,即使移植从死亡后的弯角剑羚组织中采集的细胞核,也与小鼠的细胞核一样诱导了初始化重编程,并确认胚胎基因被激活。
此次,研究团队构建了从包括死亡野生动物和濒危动物在内的哺乳动物基因组中诱导转录的实验系统。利用这种新方法,不仅是基因组的碱基序列分析,还可以获得关于基因组序列如何工作的信息。这对了解生物多样性非常重要。此外,利用该方法还成功克服了以往野生动物细胞初始化重编程障碍,如胚胎分裂异常和胚胎基因激活失败的问题。研究团队今后计划进一步发展该方法,并挑战初始化重编程野生动物基因组的扩增,以保护宝贵的基因组资源。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部













