ATP(三磷酸腺苷)是一种参与储存和使用能量以支持生命活动的分子。最近的研究报告显示,ATP可以抑制蛋白质的淀粉样蛋白纤维化,但还不清楚ATP是如何稳定蛋白质的。京都大学研究生院工学研究科博士生(当时)西泽茉由、助教森本大智、教授白川昌宏、副教授菅濑谦治和医学研究科的助教埃里克·瓦林达,与德国莱布尼茨高分子研究所的研究员本杰明·科恩和部门长乌尔里希·谢勒组成的研究团队,在全球首次利用NMR(核磁共振)在原子水平上成功检测到了浓度与细胞内基本相同的ATP与蛋白质进行微弱的非特异性相互作用,以及ATP之间会自缔合。菅濑副教授表示:“ATP可能是通过自缔合与蛋白质的疎水部分相结合,从而稳定蛋白质的。生物体内的ATP会随着年龄的增长而减少。所以可以考虑通过服用药物或保健品来防止ATP的减少,以便抑制淀粉样蛋白纤维化,预防神经退行性疾病”。相关成果已经发布在美国学术期刊《Journal of the American Chemical Society》上。
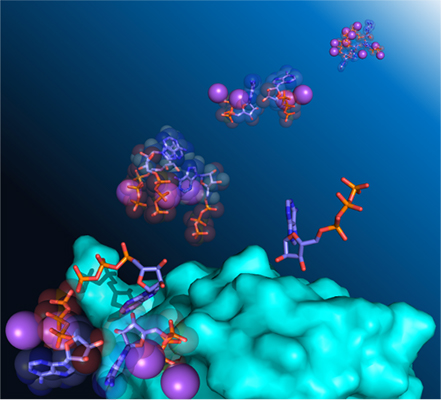
图:研究发现,ATP会微弱地进行自缔合,并与蛋白质相互作用。棒状图案表示ATP分子,球体表示离子,蛋白质表面用浅蓝色表示。
细胞内存在的单个蛋白质的浓度约为0.01毫摩尔,而ATP在细胞内的浓度高达5~10毫摩尔。每当一个磷酸基被移除,ATP都会释放能量,因此被称为生命的能量货币。另一方面,研究发现ATP具有稳定蛋白质,抑制淀粉样蛋白纤维化的功能,但一直不清楚ATP是如何与蛋白质相互作用并稳定蛋白质的。
研究团队认为,ATP稳定蛋白质时的相互作用非常弱,因此之前被忽略了,于是利用即使是非常弱的相互作用也能在原子水平上检测到的NMR,分析了ATP与蛋白质的相互作用。分析对象为淀粉样蛋白纤维化的α突触核蛋白、高度稳定的泛素和形成自二聚体的p62。
首先,向浓度与细胞内基本相同浓度(50微摩尔)的蛋白质中逐渐添加ATP,每次添加时都测量NMR光谱。由此发现蛋白质的NMR信号略有偏移。这意味着ATP与蛋白质发生了非常弱的相互作用。此时,化学位移的变化方式与以往不同,在低浓度时几乎没有变化,而浓度升高后显著变化。此前已经知道ATP稳定蛋白质的效果从浓度达到5毫摩尔左右时开始出现,而此次发现化学位移也在浓度为5毫摩尔左右时显著发生变化。
接下来,进行了动态光散射测量、扩散系数测量和热量测量。动态光散射测量显示,ATP的浓度升高后,表观分子尺寸会随之变大。扩散系数测量显示,ATP溶液中存在微量的进行自缔合且扩散速度放缓的成分。热量测量检测到了自缔合解开时被吸收的热量。另外还通过分子动力学计算调查了ATP是如何进行自缔合的。结果发现存在各种各样的聚集体,也就是说,ATP在浓度较高时会进行自缔合。
另外,研究团队还着眼于存在ATP时一些蛋白质的NMR信号会增强的情况。观测到的NMR信号来自蛋白质的酰胺基,但酰胺基的氢原子很容易与水的氢原子交换。一般来说,发生这种氢交换的话,NMR信号就会减弱。因此,研究团队认为ATP放慢了酰胺基与水之间的氢交换速度,于是进行了分析。例如,泛素Gly75在存在ATP时,氢交换速度会减慢。换句话说,可以解释为ATP包围了蛋白质,使得水分子不容易靠近蛋白质。
由于蛋白质存在一些容易吸附其他分子的区域,因此ATP有可能通过包围它,包括这些区域在内来稳定蛋白质。上述结果在所分析的3种蛋白质中均存在,所以可以说这是ATP的一般属性。
原文:《科学新闻》
翻译编辑:JST客观日本编辑部













