上接: 【人物】细胞粘附分子“钙粘蛋白”的发现者——竹市雅俊(上)
不落俗套 另辟蹊径
晶状体分化研究是由冈田教授本人主持的,之后陆续有安田国雄(后任奈良先端科学技术大学院大学校长)和近藤寿人(后任大阪大学教授)等人加入,该项研究确定了在晶状体细胞中发挥作用的结晶素基因的结构,并成为冈田教授实验室的一个中心主题。该项研究与视网膜细胞“分化和转化”为晶状体细胞的研究有关。换句话说,现在盛行的研究在30年前就已经是冈田教授研究室的研究题目了。
在培养晶状体细胞时,首先用一种叫做胰蛋白酶的酶将它们打碎,然后铺在培养皿上。细胞之间的粘附关系被打破后,细胞一个个变成了圆形,它们会沉到底部,粘在盘子上形成一个扩散的形状,但它们的粘附方式因条件不同而不同。然而,细胞附着在培养皿上的方式因条件不同而不同。在加入视网膜培养液成分时,细胞附着在培养皿上的速度更慢。
但是很快竹市开始厌倦简单地观察晶状体细胞的分化,因为什么有趣的事情都没有发生。他觉得这个过程里面可能有一些有趣的东西。因为细胞粘附在培养皿上的现象可以通过改变培养条件来“操纵”,所以可以通过建模并测试的方法来做分析新实验。因为视网膜培养液中含有多种蛋白质,所以他尝试用血液中的常见成分白蛋白作为模型,观察是否有某种特定的蛋白质参与粘附,结果发现粘附被延迟了。当他把该结果上报之后,冈田教授也觉得这个发现很有趣。但当冈田教授问他打算如何开展晶状体的研究时,一筹莫展的他几乎要选择放弃,而转为研究细胞粘附的课题。因为冈田教授当时正在进行关于肾脏肢解后的细胞重新组合和分类的开创性研究,所以对他的决定表示了理解和支持。但在当时来说,和细胞分化相比,细胞粘附只是胚胎学中的一个小课题。从某种意义上说,他勇敢地走出了自己的舒适区,抱着一定会有新发现的信念,在精神上得到了解脱。
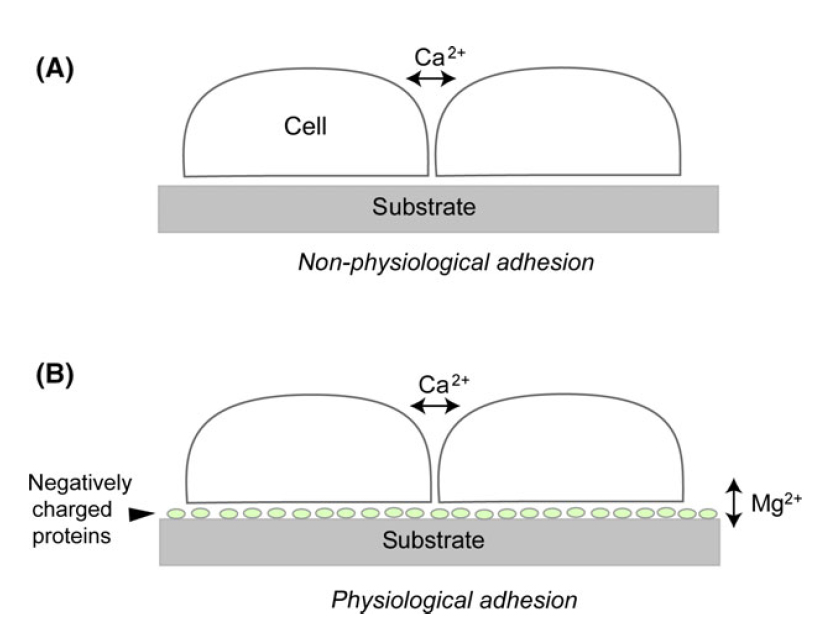
纤维细胞粘附在塑料或玻璃基质上的两种模式。
(A) 培养基不含蛋白质。在这种情况下,细胞附着在基质上不需要任何生理条件,如二价阳离子和生理温度。
(B) 培养基含有蛋白质,这些蛋白质被吸附在基质表面,导致细胞附着在蛋白质涂层的基质上。Mg2+或Mn2+促进这种附着,而Ca2+在这个过程中效果较差。另一方面,Ca2+对促进细胞-细胞粘附很重要。
竹市在发现培养基中蛋白质的存在会延迟粘附后,又研究了钙离子和镁离子的影响。虽然已经知道这些二价阳离子参与了粘附,但经过更仔细的研究,才得以区分出细胞粘附在培养皿上需要镁离子,而细胞之间的粘附需要钙离子。因此,他推测细胞之间的粘附和培养皿等非细胞之间的粘附是两种不同的现象,并且有不同的蛋白质参与其中。但是细胞中有许多蛋白质,没有办法找出哪一种蛋白质参与粘附,也就是说当时没有合适的方法来检验这个推测。正当他以为自己的研究又走进死胡同的时候,冈田教授建议他出国深造。在冈田教授曾经求学的卡内基科学研究所(Carnegie Institution for Science)里,迪克·帕加诺(Dick Pagano)实验室正在开展脂质体的人造膜和细胞膜之间的相互作用的研究,为了寻找研究的突破口,他于1974年踏上了赴美研究之路。

1975年江口吾朗(左)和竹市雅俊(右)在巴尔的摩的合影。(图片出处:2004 年 2 月 国际发育生物学杂志)
峰回路转 勇于探索
在卡内基科学研究所的实验室里,竹市使用的是一种名为V79的仓鼠衍生细胞系来观察细胞的粘附性,他在研究其基本特性时遇到了一个从未见过的奇怪现象。之前在京都大学的实验室里,当培养的细胞被胰蛋白酶分解,然后在培养液中旋转时,细胞会重新组合。然而在这里,即使执行同样的程序,V79细胞却没有重新组合。当他检查溶液的成分是,发现其中含有一种叫EDTA的化学物质,它可以抵消镁、钙等二价离子的作用。最终,他意识到,胰蛋白酶溶液中是否存在钙离子会导致至关重要的区别。当用胰蛋白酶溶液处理细胞时,如果存在钙,其粘附性就会被保留下来,如果没有钙,其粘附性就会消失。通过更深一步的观察后发现,细胞之间的粘附既是钙依赖性,也是钙非依赖性的,而钙依赖性机制担负的粘附。而当将具有钙依赖性粘附性的细胞与没有这种能力的细胞进行比较时,得以推测出细胞表面某种蛋白质的存在与否是粘附的原因。
两年的博士后研究生活结束之后,竹市回到了京都大学,集中精力探明是何种蛋白质。当时,用于搜索未知蛋白质的方法是筛选抑制蛋白质活性的抗体。这种方法后来演变成了单克隆抗体筛选法。如果能够获得与V79细胞的粘附蛋白反应的抗体,那么这些抗体应该能够抑制钙依赖性的细胞粘附。该抗体应作为鉴定粘附蛋白的工具。然而,尽管他尝试了许多方法,但根本无法获得这种抗体。正当他为这个问题苦恼的时候,有一篇论文给予了他灵感。该论文中称,当针对F9小鼠衍生细胞制作的抗体在小鼠分裂期间与受精卵发生反应时,细胞之间的结合变得更加松散。他凭直觉认为,该现象一定与其正在研究的同一种蛋白质有关,于是将细胞换成F9,顺利找到了抑制其粘附的抗体。该抗体确定了负责钙依赖性细胞粘附的膜蛋白,因此,可以建立一个细胞粘附机制的模型。负责细胞之间粘附的蛋白质被钙离子激活,在没有钙离子的情况下无活性,同时它容易被蛋白酶(如胰蛋白酶)分解。之所以在F9上取得突破,可能是因为F9所具有的钙粘蛋白类型更容易被识别为抗原。冈田教授催促他尽快给这个重要的粘附分子起个名字,在与参与这项研究的其他人员后协商后,他们决定用“钙(calcium)”和“粘附(adhere)”组合成其名称“钙粘蛋白(cadherin)”。
至目前为止,人类已发现100多种不同类型的钙粘蛋白。大多数细胞在其细胞膜上都有几种类型的钙粘蛋白,钙粘蛋白的组合也因细胞而异。当各种钙粘蛋白将细胞连接在一起时,它们会专门地与同类型的钙粘蛋白结合。换句话说,具有相同钙粘蛋白的细胞会相互粘附,但不会与具有不同钙粘蛋白的细胞粘附。事实上,在20世纪50年代,美国发育生物学家约翰内斯·霍尔特弗雷特(Johannes Holtfreter)等人就发现,当组织被打散后,相同类型的细胞会聚集在一起并进行自我重建,并将此称为“细胞分选(cell sorting)”。由此看来,钙粘蛋白在细胞分选中起到了一定的作用。例如在发育过程中,细胞被反复地聚拢和分离,这被认为是通过改变细胞产生的钙粘蛋白的类型来实现的。
现在,有很多研究者在研究钙粘蛋白。细胞分化的研究仍是发育研究的主流,但分化的细胞是如何建体对胚胎学来说同样重要,而研讨这个问题就离不开细胞粘附。虽然看上去没有钙粘蛋白的发现那么耀眼,但将细胞粘附这一难以捉摸的现象发展成为一门精密科学,竹市也感到非常自豪。他回顾了自己的研究历程,即通过分析细胞之间的粘附和细胞与培养皿之间的粘附的区别,也通过分析钙离子参与的细胞之间的粘附和钙离子不参与的细胞之间的粘附的区别,也就是说他仔细地研究了与细胞粘附有关的每个单独现象。虽然有很多研究细胞粘附的先驱者,但他们似乎没有这样的精确度。之所以有这样的发现是大量研究积累的结果。旁人很难看到这些过程,但是研究成功的精髓恰恰就在于此。

竹市雅俊(左三)和高阶结构形成研究小组成员的合影(图片出处:理化学研究所官网)
竹市并没有躺在功劳簿上睡大觉,在之后的时间里,他开始了与大脑形成有关的研究。因为大脑是由一千多亿个神经元组成的复杂网络,虽然整体上可能看起来很复杂,但如果观察每个细胞的话,会发现它正在延伸一个轴突,与另一个细胞建立突触连接,所以这仍然是一个粘连的问题。通过研究已经发现钙粘蛋白也参与了突触的形成,而且不同的钙粘蛋白在大脑的不同特定区域发挥作用。除此之外他也开始了与癌症相关的研究。因为许多癌细胞已经失去了钙粘蛋白的活性。这种癌细胞离开原有组织,转移并侵入其他组织而成为恶性肿瘤。在某些情况下,钙粘蛋白本身已经从细胞中丢失,但在大多数情况下,虽然细胞中仍有钙粘蛋白,但它不能正常工作。如果能够查明发生这种情况的原因,或许就能研发出一种预防癌症转移的方法。
在被问及如何才能成为一名优秀的研究者时,竹市回答说需要对未知领域有一个准确的认知,即要了解哪些是自己不知道的,又要认识到可以开展哪些研究来开拓未知领域。找到这个感受的最好方法就是做自己喜欢的事情。正是一个人所热爱的事物才会让这个人变得充满激情,也才能够看到未知的深度。正如他从读研究生的时候开始就一直在做自己想做的事情一样,虽然和现在相比,当时的学术界并不成熟,研究方法本身也处于混乱状态。正因如此每个研究者都需要主动去探索自己感兴趣的领域。相反,现在的信息量太大,实验室的管理已经系统化,为了有效地收集数据,研究主管需要对研究进行控制,密切注意实验室里的主要课题政策。即便如此,不少真正有趣的研究是作为研究人员的自由研究的意外成果出现的。研究主管提出的假设往往只是一个起点,科研工作往往不会按照最初的设想前进,需要尝试走过各种蜿蜒曲折的途径,其中既有死胡同也会有意想不到的近道,生命现象并不是简单到仅靠人的思维就能解决的。唯有热爱生命现象,才能在漫长的研究道路上越走越远。
参考文献
1. The International Journal of Developmental Biology , February 2004 ,48(5-6):387-96
2. The EMBO Journal, January 2018, 5(10):2485-2488
3. 京都大学公共关系杂志 2020年秋季号
供稿:马佳宥
编辑修改:JST客观日本编辑部













