本文根据理化学研究所成果发布编译而成
由日本理化学研究所(简称“理研”)计算科学研究中心粒子系生物物理研究团队的杉田有治担任组长的研究团队,利用超级计算机“富岳”和“Oakforest-PACS”对新冠病毒(SARS-CoV-2)表面存在的“刺突蛋白”进行的模拟计算发现,修饰刺突蛋白表面的糖链在病毒入侵人体细胞时发生的刺突蛋白结构变化中发挥着重要作用。
2020年12月在英国发现的突变病毒株中存在17处突变,传染性比以前更强。全球各国都在对刺突蛋白进行分子动力学模拟,利用“富岳”模拟计算获得的蛋白质详细结构信息可以为药品开发提供线索。利用“富岳”和“Oakforest-PACS”能进行高速分析,对于突然出现的突变病毒株等问题,也可以利用超级计算机迅速应对,由此有望为预防和治疗新冠病毒感染症(COVID-19)的药物的分子设计做出贡献。
新冠病毒表面存在的刺突蛋白结构变化机制
在新冠病毒进入人体细胞的初期阶段,病毒表面存在的蛋白质(刺突蛋白)会与人体细胞表面的血管紧张素转化酶II(ACE2受体)结合并吸附到细胞上面,随着病毒入侵发生感染(图1A)。刺突蛋白由3条多肽链组成,每条多肽链由N端结构域(NTD)、受体结合结构域(RBD)和S2结构域构成(图1B左)。生物化学实验还显示,刺突蛋白表面的很多氨基酸都是由糖链修饰的。不仅是刺突蛋白,很多蛋白质的表面都通过翻译后修饰增加了糖链,研究认为,蛋白质相互识别时就利用这些糖链。另外,就病毒而言,还有观点认为,刺突蛋白为躲避抗体的攻击而被糖链包裹住了。
研究团队利用X射线晶体结构分析法和冷冻电子显微镜进行单颗粒分析发现,新冠病毒的刺突蛋白具有“向下型”(Down型)和“向上型”(Up型)两种结构(图1B)。在向上型结构中,RBD会从S2亚基移开(图1B红色部分)。另外还发现,刺突蛋白不与ACE2受体结合时,会在向下型和向上型之间来回变化(平衡状态),与ACE2受体结合后,向上型会变得更稳定。
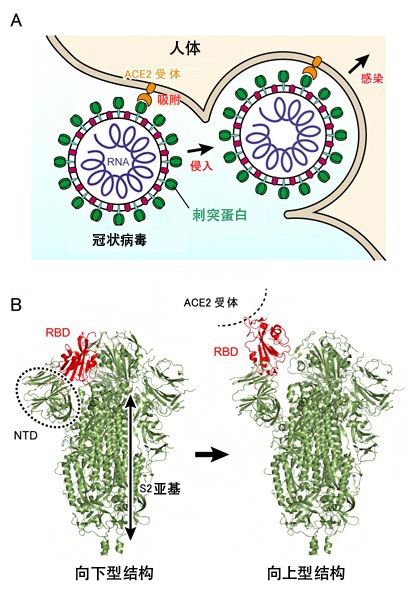
图1:新冠病毒SARS-CoV-2的感染机制
研究团队为调查刺突蛋白的详细分子结构,利用超级计算机“富岳”和“Oakforest-PACS”,对向下型结构和向上型结构进行了分子动力学模拟(图2A)。分子动力学模拟是通过在计算机中构筑虚拟分子系统,并求解每个原子的牛顿运动方程式F=ma,来从理论上预测稳定的分子结构,以及可视化分子运动的方法(图2B)。分子系统非常大时,运算量也很庞大,因此需要利用超级计算机进行高速计算。
研究团队2015年自主开发出了分子动力学计算软件GENESIS。GENESIS被选为“富岳”协同设计开发的目标应用之一,Jaewoon Jung专任工程师和小林千草工程师等人主导针对“富岳”进行了优化,应用执行性能达到“京”的100倍以上。此次利用GENESIS,对刺突蛋白进行了1微秒(100万分之1秒)的分子动力学计算,全面分析了RBD结构变化之前和之后的氨基酸-氨基酸及糖链-氨基酸之间的相互作用。
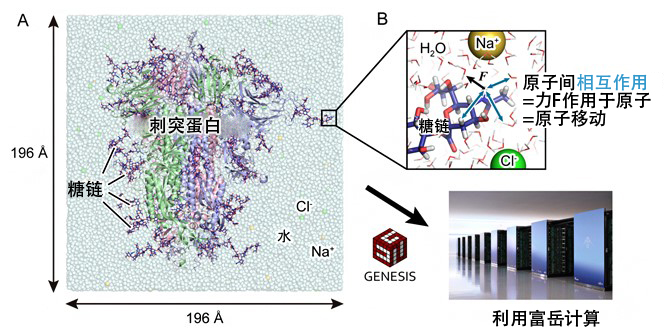
图2:利用GENESIS和“富岳”模拟SARS-CoV-2的刺突蛋白
由此发现,修饰刺突蛋白第165位、第234位和第343位三个天冬酰胺N165、N234和N343的各糖链在RBD的结构稳定中发挥着重要作用。在向下型结构中,N343和N165的糖链分别连接RBD-RBD(图3A上)和RBD-NTD,从上方覆盖住了RBD(图3B上)。变为向上型时,N343的糖链脱落(图3A下),然后进入N234的糖链变为向上型时产生的RBD-S2结构域之间的空腔(图3C),并与S2结构域和RBD形成强氢键,以从下面强化移动到上部的RBD(图3B下)。
另外,对向下型结构实施静电势分析发现,三个RBD的边界面通过第378位赖氨酸(K378,图3A中央蓝色)和第407位精氨酸(R407)等大范围带正电。
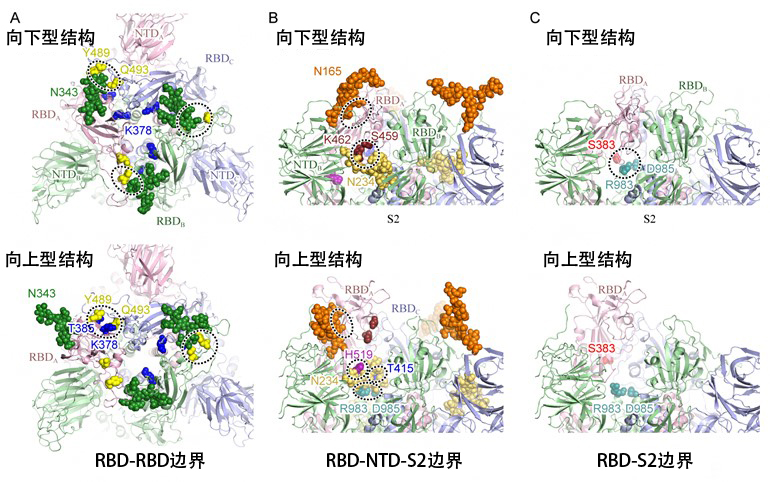
图3:刺突蛋白中的氨基酸-氨基酸及氨基酸-糖链相互作用
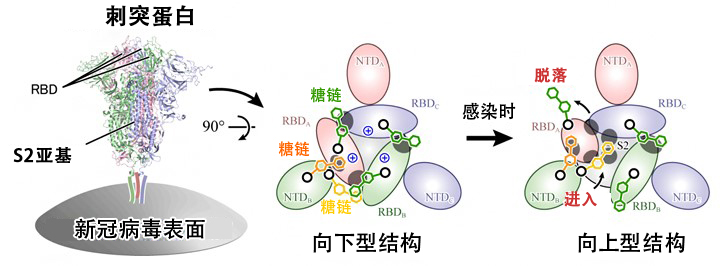
这些结果表明,结构朝向上型变化是以RBD间的静电斥力为驱动力发生的,另外,稳定向下型结构的糖链脱落,RBD移动后,其他糖链会进入(图4)。研究团队不仅通过此次研究明确了新冠病毒感染的详细分子机制,还成功发现了糖链稳定蛋白质动态结构的新生物学知识。
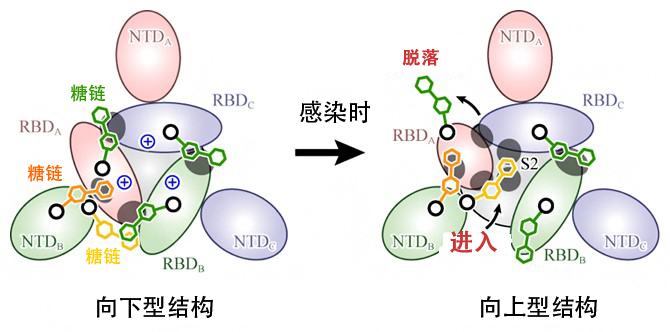
图4:刺突蛋白的结构变化机制
刺突蛋白的俯视图。由向下型变为向上型的结构变化以RBD间的正电荷(中央蓝色+标记)形成的静电斥力为驱动力发生,稳定向下型结构的糖链(绿色)脱落,RBD移动后,其他糖链(黄色)进入,稳定向上型结构。
研究团队此次的发现着眼于在刺突蛋白的结构变化中发挥增强作用的糖链,有望创造新的治疗战略,例如“防止向下型的RBD-RBD间的糖链脱落”,或者“抑制变为向上型时进入的糖链”等。
论文信息
题目:Elucidation of interactions regulating conformational stability and dynamics of SARS-CoV-2 S-protein
期刊:Biophysical Journal
DOI:10.1016/j.bpj.2021.01.012
日语发布资料
编译:JST客观日本编辑部














