本文根据理化学研究所成果发布翻译整理而成
日本理化学研究所(简称“理研”)生命医科学研究中心的水上圭二郎研究员和桃泽幸秀组长,与东京大学医科学研究所人类癌症病因基因领域的村上善则教授、东京大学研究生院新领域创成科学研究科的镰谷洋一郎教授、国立癌症研究中心基因诊疗部门的吉田辉彦部门主任以及枥木县立癌症中心的菅野康吉基因组主任等人组成的国际联合研究团队,实施了全球最大规模的DNA分析(2万人以上),查清了日本人的遗传性胰腺癌的致病基因、发病风险和临床特征。
该研究成果有望为实现“基因组医疗”做出贡献,即有望针对日本的每一位胰腺癌症患者提供量身定制的精准治疗。
胰腺癌的基因组医疗
背景
胰腺癌是世界各国的发病率均呈增加趋势的癌症之一,特点是5年生存率非常低,即使在早期就被发现,5年生存率也只有42%。据说大约10%的胰腺癌症患者是家族性胰腺癌,其发病与遗传易感性有关。
基因检测可以确定疾病的遗传易感性之一的病理突变。通过对癌症患者实施基因检测,能选择合适的治疗药物以及早期对近亲进行癌症筛查等。例如,近年来报告的临床研究结果显示,BRCA1基因或BRCA2基因缺损的胰腺癌患者通过使用PARP抑制剂之一令癌莎,能延长无进展生存时间。基因检测可以筛查适合使用这些药物的患者,因此其重要性日益增加。另一方面,考虑到患者的经济和心理负担等问题,提前缩小目标检测患者的范围也很重要。不过,目前尚不存在能有效缩小胰腺癌目标检测患者范围的标准,因此美国国家综合癌症网络(NCCN)的指南建议对所有胰腺癌患者都实施胰腺癌相关的基因检测。但与乳腺癌等相比,胰腺癌中可作为这些指南依据的大规模基因组分析的数量比较少,涵盖的种族群体也有限。
因此,国际联合研究团队利用大规模的样本,明确了与日本人罹患的胰腺癌的致病基因和病理突变有关的临床信息,生成了可用于胰腺癌基因组医疗的数据,同时调查了现在的指南是否适用日本患者。
研究方法与成果
国际联合研究团队利用理研自主开发的基因组分析法,针对包括NCCN指南中建议检测的11个基因在内的共计27个胰腺癌遗传性肿瘤相关基因,分析了日本生物银行收集的1,009名胰腺癌患者(疾病组)的DNA。由此确定了3,610个基因突变。另外,还根据美国医学遗传学与基因组学学会(ACMG)制定的指南及国际数据库ClinVar,对这些基因突变是否属于病理突变逐一进行了分类,确定其中205个基因突变属于病理突变。
研究团队利用疾病组数据和通过分析大肠癌基因组生成的23,780人的对照组数据,比较了各基因携带这些病理突变的比例,发现BRCA1/2以及ATM三个基因与胰腺癌的发病明显相关。另外,在这三个基因中检测出来的病理突变中,79%的突变在疾病组中只有一人携带(图1)。尤其是发现ATM基因拼接位点的突变之一仅与胰腺癌有关。5.1%的胰腺癌患者这三个基因都发生了病理突变。
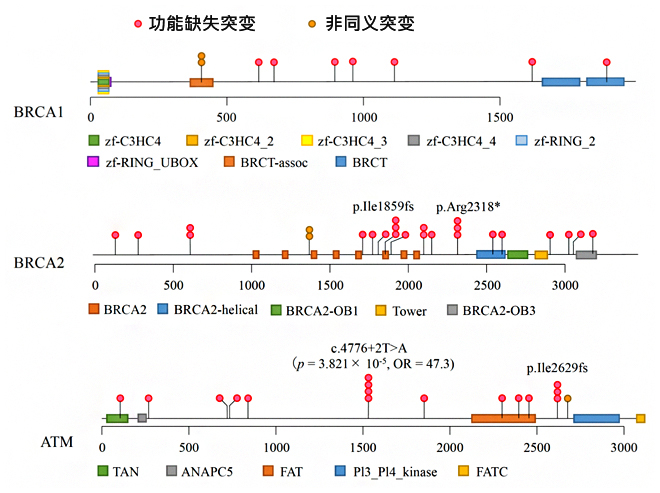
图1:BRCA1/2及ATM基因存在的病理突变的位置及携带人数
接下来,研究团队调查了这三个基因的病理突变携带者的临床特征。首先调查了携带病理突变与否与胰腺癌发病后的生存时间之间的关系,确认携带病理突变与否对生存时间没有影响(图2)。
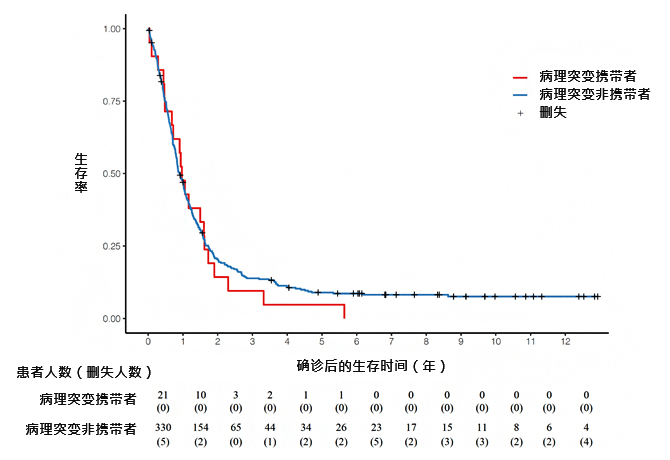
图2:病理突变携带者确诊胰腺癌后的生存时间差异
另外,还调查了与确诊年龄之间的关系,未发现桃泽幸秀组长等人过去在乳腺癌和前列腺癌研究中发现的病理突变携带者的发病年龄偏低等趋势。但发现病理突变携带者高比例拥有胃癌或卵巢癌家族史,或者存在严重的淋巴管浸润倾向。
如上所述,明确病理突变携带者特有的临床特征对有效缩小基因检测对象的范围至关重要。不过,本次研究截至目前明确的胰腺癌病理突变相关的临床信息,与海外多个数百人规模的基因组研究的结果并不完全一致,因此依然难以有效缩小基因检测对象。
此外,本次研究还调查了能否利用机器学习通过临床信息预测是否存在病理突变。预测使用了日本生物银行中录入的临床信息。首先,为调查基于机器学习的预测是否有效,研究团队利用基因检测对象的选择标准已在NCCN指南中实现实用化的乳腺癌确认了预测精度。最终确认,能以与NCCN指南相同的精度预测是否发生病理突变(图3A)。
因此,研究团队利用同样的方法对胰腺癌进行了预测,发现与乳腺癌不同,胰腺癌的预测精度非常低(图3B)。这表明,胰腺癌即使利用机器学习,也难以根据临床信息缩小基因检测对象的范围。
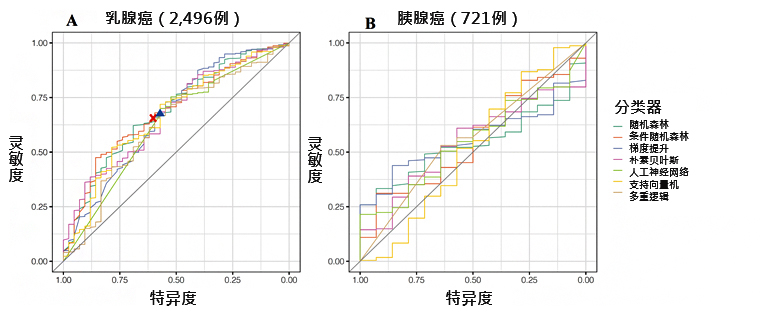
图3:预测是否发生病理突变的机器学习的预测精度
此次研究获得的各种突变的摘要信息将录入生物科学数据库中心(NBDC)。得到NBDC的许可后,可自由用于今后的研究。另外,各种病理突变的摘要信息还预定录入日本临床基因组信息综合数据库(MGeND)中,有望为临床现场的基因突变解释提供重要的信息。
论文信息
题目:Genetic characterization of pancreatic cancer patients and prediction of carrier status of germline pathogenic variants in cancer-predisposing genes
期刊:EBioMedicine
doi:10.1016/j.ebiom.2020.103033
日语发布原文
编译:JST客观日本编辑部














