大阪大学研究生院医学系研究科的长野清一副教授(神经内科学)及日本国立精神和神经医疗研究中心(NCNP)神经研究所疾病研究第五部的荒木敏之部长等人组成的研究团队发现,与肌萎缩性侧索硬化症(ALS)和额颞叶变性(FTLD)发病有关的蛋白质TDP-43会调节核糖体在神经细胞轴突局部的蛋白质合成功能。另外还发现,该轴突的功能障碍可能与ALS和FTLD的发病有关。另外,吉林大学中日联谊医院神经内科的Yinshi Jin也参加了此项研究。
ALS和FTLD分别是因运动神经和大脑皮层神经受损而引起全身肌肉无力、肌肉萎缩以及痴呆症的神经疾病。研究发现,这两种疾病均存在名为TDP-43的蛋白质以神经细胞内为中心异常积累(沉积)的现象。不过,此前一直不清楚TDP-43在神经细胞中是如何发挥作用的,以及TDP-43沉积是如何引起ALS和FTLD的。
TDP-43具有与信使RNA(mRNA)结合的特性,研究显示,TDP-43会与大量mRNA结合并促进其在细胞内的成熟和转运。此次,研究团队着眼于神经细胞的轴突,作为通过TDP-43转运到轴突的重要mRNA,确定了编码核糖体蛋白的mRNA(核糖体蛋白mRNA)。研究发现,TDP-43通过将核糖体蛋白mRNA转运至轴突,能维持轴突产生的核糖体蛋白的量,而这能维持在轴突中合成各种蛋白质所需的核糖体的数量,从而保持神经细胞的形态和功能(图1)。
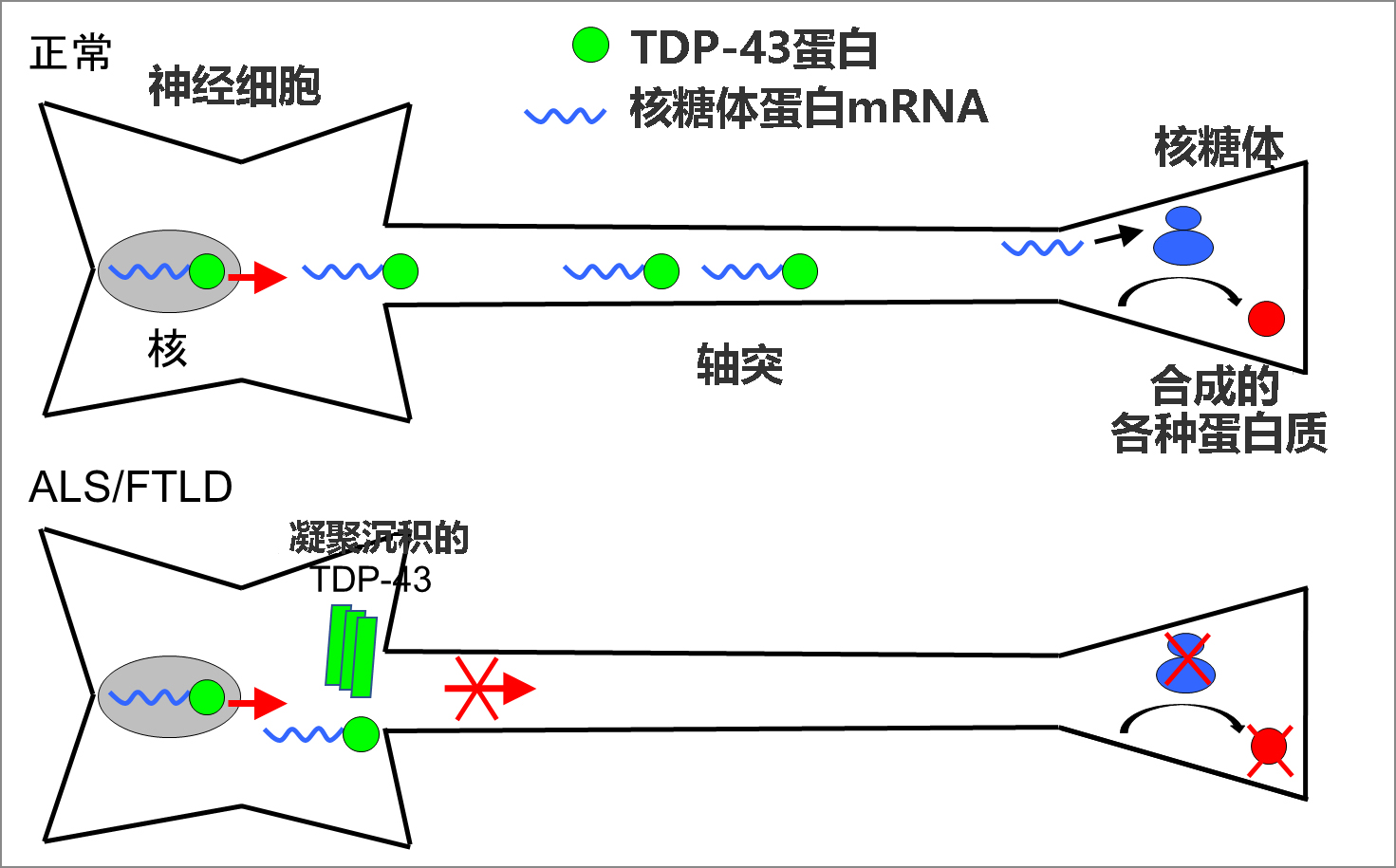
图1:TDP-43的异常沉积引起的ALS和FTLD的病理模型
该研究团队认为,TDP-43在神经细胞内的异常沉积,可能导致无法形成正常的RNA颗粒,因此无法将所需的mRNA转运至神经突起,尤其是长神经突起——轴突,这可能会引起神经细胞损伤,从而引发ALS和FTLD,因此探索了通过TDP-43转运至轴突的mRNA。
核糖体蛋白是构成核糖体、即通过mRNA产生蛋白质所必须的细胞内合成装置的蛋白质,会大大影响核糖体对蛋白质整体的翻译效率。研究团队将核糖体蛋白的mRNA用于培养神经细胞并进行详细解析发现,核糖体蛋白mRNA在轴突内以颗粒状存在于与TDP-43相同的位置,核糖体蛋白mRNA与TDP-43会相互结合,随着TDP-43减少,向轴突转运的含核糖体蛋白mRNA的颗粒也减少。另外还发现,转运至轴突的核糖体蛋白mRNA通过刺激神经细胞,在轴突内被翻译成核糖体蛋白,为维持核糖体的翻译功能发挥了重要作用。
研究团队还确认,使培养的神经细胞和小鼠脑内的神经细胞中的TDP-43减少后,轴突的生长会逐渐恶化,但同时使多种核糖体蛋白mRNA过度表达时,随着核糖体蛋白的恢复,轴突的生长得到改善(图2)。此外,还在TDP-43异常沉积的ALS患者的脑组织中,调查了主要是运动神经轴突在运行的部位,发现多种核糖体蛋白mRNA减少。
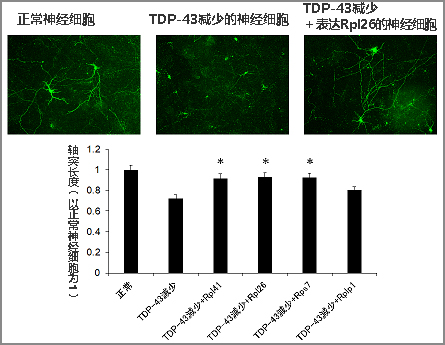
图2:核糖体蛋白mRNA对TDP-43减少的神经细胞中发生的轴突生长障碍的改善效果
使小鼠大脑皮层神经细胞中的TDP-43减少后,抑制了轴突的生长,但此时使4种不同的核糖体蛋白(Rp)mRNA分别过表达发现,其中3种(带*记号的)明显改善了轴突的生长。
论文信息
题目:“TDP-43 transports ribosomal protein mRNA to regulate axonal local translation in neuronal axons.”
期刊:Acta Neuropathologica
URL:link.springer.com/article/10.1007/s00401-020-02205-y
文:JST客观日本编辑部