日本东京工业大学信息理工学院信息工学系的关嶋政和副教授,该校物质与信息卓越教育院的安尾信明特任讲师和筑波大学医学医疗系生命医科学领域的吉野龙之介助教组成研究团队,利用超级计算机TSUBAME3.0进行分子动力学模拟,成功建立了抑制参与新冠病毒(SARS-CoV-2)复制的“主蛋白酶”功能的治疗药物候选化合物应该满足的药效团模型。另外,还利用靶向主蛋白酶的候选药物α-酮酰胺抑制剂(参考文献)确认该药效团是正确的。
寻找新冠病毒感染症(COVID-19)治疗药物时主要利用药物重定位法,即以现有药物或者通过了部分临床试验的药物为基础进行探索,这样可确保安全性并缩短开发时间。此次研究确认的药效团不仅可用于现有药物的探索,还可以用来探索新的药物候选化合物,就这一点而言,可以说是一项重要的成果。
今后计划以该药效团为基础,通过结合了模拟及统计机器学习等人工智能(AI)和生物化学实验的智能新药开发,探索能成为新冠病毒感染症(COVID-19)的候选治疗药物的具体化合物。
目前发现的事实是,新冠病毒最早于2019年12月在中国武汉出现,随后引起大流行。截至2020年8月下旬,新冠病毒感染症的感染人数已经超过2300万人,死亡人数超过80万,目前感染仍在持续扩大之中,全球都在寻找治疗药物。以前有报告显示,肽样抗HIV-1药物能有效抑制参与SARS病毒(SARS-CoV)复制的主蛋白酶。由于SARS-CoV与SARS-CoV-2之间有密切的系统关联,主蛋白酶在结构和功能上有很多共同特征(图1)。因此,肽样抗HIV-1药物也被认为是靶向SARS-CoV-2的主蛋白酶的候选药物,不过一直不清楚SARS-CoV-2的主蛋白酶在原子水平上的作用机理。
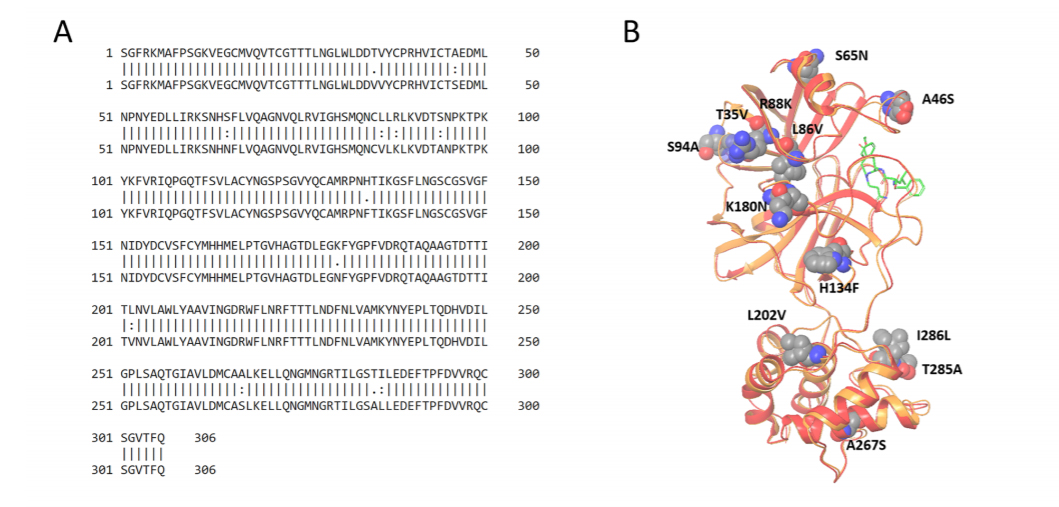
图1:SARS病毒(SARS-CoV)与新冠病毒(SARS-CoV-2)的主蛋白酶氨基酸序列和蛋白质立体结构的比较。氨基酸序列有96%相同。
此次研究团队利用超级计算机TSUBAME3.0在1微秒的时间尺度上实施分子动力学(MD)模拟,明确了SARS-CoV-2的主蛋白酶与3种药物候选化合物之间的重要相互作用,并成功建立了药效团模型。在所有的MD模拟中,SARS-CoV-2主蛋白酶的第41位His(组氨酸)、第153位Gly(甘氨酸)和第166位Glu(谷氨酰胺酸)都与化合物的同一个官能团相互作用。这个结果表明,相互作用是作用于SARS-CoV-2主蛋白酶的药物的重要靶标。
为验证建模的药效团的正确性,研究团队调查了已知能以IC50=0.67±0.18μM抑制SARS-CoV-2主蛋白酶功能的α-酮酰胺抑制剂是否符合该药效团。结果确认,α-酮酰胺的一个羟基和两个羰基与药效团模型一致(图2)。
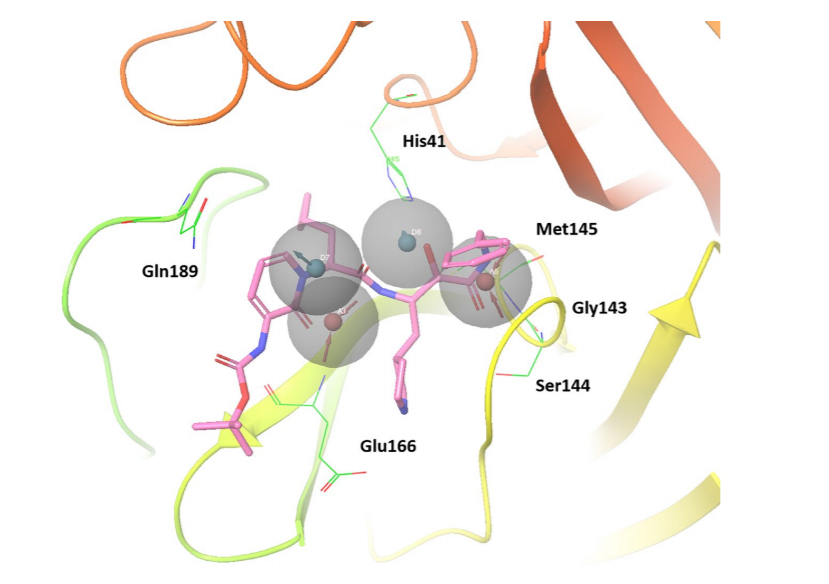
图2:围绕SARS-CoV-2主蛋白酶和候选药物α-酮酰胺抑制剂,验证是否符合本次研究建模的药效团
SARS病毒(SARS-CoV)有很多与主蛋白酶的第145位Cys(半胱氨酸)共价结合的不可逆性抑制剂,这些抑制剂可能具有比竞争性抑制剂更高的结合亲和性。不过,对于COVID-19等高度紧急的疾病来说,药物重定位比较有效,为了与Cys形成共价键,此次研究提出的药效团可以评估不含官能团的化合物。
【参考文献】
Zhang et al., Crystal structure of SARS-CoV-2 main protease provides a basis for design of improved α-ketoamide inhibitors,Science 24 Apr 2020:Vol. 368, Issue 6489, pp. 409-412,DOI: 10.1126/science.abb3405
论文信息
论文题目:Identification of key interactions between SARS-CoV-2 mainprotease and inhibitor drug candidates
发表期刊:Scientific Reports
DOI:10.1038/s41598-020-69337-9
文:JST客观日本编辑部














