东京大学研究生院农学生命科学研究科的久和教授等人利用小鼠冠状病毒进行研究发现,①在冠状病毒传染病中,细胞毒性T细胞(CTL)和干扰素-γ(IFN-γ)在从体内清除病毒的过程中发挥着重要作用;②在免疫缺陷状态下会出现病毒基因组发生突变的抗CTL冠状病毒;③发生突变的抗CTL冠状病毒在特定小鼠身上呈现出高致病性等。久和教授等人以这些研究成果为中心,总结并发布了CTL和IFN-γ在冠状病毒传染病中发挥的作用。
目前几乎没有聚焦细胞介导免疫在清除冠状病毒传染病的病毒时所发挥的作用的综述论文,此次发表的论文以实验数据为基础,合理地解说了CTL和IFN-γ的重要性,被认为非常宝贵。
通过小鼠模型获得的关于CTL和IFN-γ的信息有助于理解新冠病毒传染病(COVID-19)等其他冠状病毒传染病的病理,还有望为治疗方法(包含药物等)及预防方法(包含疫苗等)的开发提供有用的启发。
细胞毒性T细胞(CTL)对冠状病毒传染病的反应
在小鼠冠状病毒传染病的感染预防中,先天免疫和后天免疫都很重要。久和教授等人利用CD4+T缺损小鼠、CD8+T细胞缺损小鼠、CD4+T/CD8+T细胞缺损小鼠及野生型C57BL/6(B6)小鼠进行研究发现,在从肝脏清除JHMV及肝炎抑制中,CD8+T细胞尤为重要(文献1)。另外还报告,JHMV引起的致死性脑炎可通过移植JHMV特异性CD8+T细胞克隆来预防(文献2),CD8+CTL被认为在预防冠状病毒感染中发挥着重要作用。
免疫缺陷小鼠持续感染小鼠冠状病毒
在免疫系统功能减弱的宿主中,病毒感染经常会持续很久或者重症化。IFN-γ缺损B6小鼠在腹腔内接种JHMV后,会发生比野生型B8小鼠更严重的肝炎。野生型小鼠的病毒1周后被从肝脏清除,而IFN-γ缺损小鼠虽然病毒滴度减少,但没有被清除,而是持续存在。虽然肝炎逐渐好转,但引起了伴随腹腔和胸腔积水的肉芽肿性浆膜炎,小鼠最终死亡(文献3)。具有不同遗传背景的IFN-γ缺损BALB/c小鼠在腹腔内接种JHMV后发生暴发性肝炎并死亡。由此证明,遗传背景与感染的严重程度有关(文献4)。
IFN-γ缺损小鼠持续感染小鼠冠状病毒的机制
久和教授等人从感染25天后的小鼠腹腔内分离并克隆了病毒,将其命名为25V16G。对25V16G和JHMV的体外(in vitro)增殖性进行比较发现,3个培养细胞系(DBT细胞、IC-21细胞、J774A.1细胞)的病毒增殖性没有差异。比较两种病毒的S基因的碱基序列发现,25V16G有87个碱基缺损、发生两处突变。有趣的是,87个碱基缺损包含B6小鼠中的主要CTL抗原表位,表明25V16G是一种在B6小鼠体内难以被CTL识别的抗CTL病毒,据推测,这导致IFN-γ缺损的B6小鼠持续感染小鼠冠状病毒(图1)。
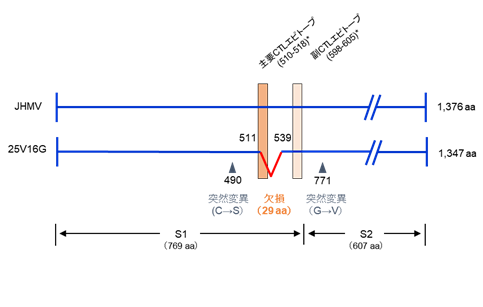
图1:小鼠冠状病毒JHM株(JHMV)及25V16G的S蛋白结构和B6小鼠的CTL抗原表位 S蛋白的分子量为180kDa,由S1结构域和S2结构域构成。与JHMV相比,25V16G有29个氨基酸残基(511-539)缺损和两处突变。Castro和Perlman报告了JHMV在B6小鼠体内的主要CTL抗原表位(510-518)和次要CTL抗原表位(598-605)(Castro, R. F. and Perlman, S. 1995. J. Virol. 69: 8127-8131)
久和教授等人在野生型和IFN-γ缺损B6小鼠的腹腔内分别接种25V16G和JHMV,比较了病理情况。感染5天后,野生型B6小鼠肝脏的25V16G病毒滴度高达JHMV的约60倍。另外,IFN-γ缺损小鼠接种25V16G后发生了暴发性肝炎,表明25V16G的致病性比JHMV高,25V16G的抗CTL性与重症化有关(文献5)。
CTL和IFN-γ在小鼠冠状病毒相关疾病中的作用
图2总结了一系列的实验结果。
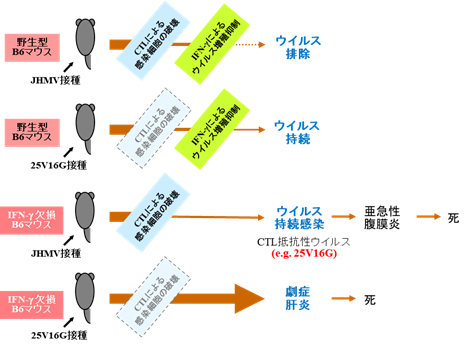
图2:一系列实验结果的总结图
●在野生型B6小鼠腹腔内接种JHMV后,会发生轻度急性肝炎,但在CTL、IFN-γ和其他机理的作用下,1周内病毒就被从肝脏清除。
●在野生型B6小鼠腹腔内接种抗CTL病毒25V16G后,与JHMV不同,1周内病毒没有被从肝脏清除。
●在IFN-γ缺损B6小鼠腹腔内接种JHMV后,发生比野生型B6小鼠更严重的肝炎。肝脏的病毒滴度在接种5天后达到峰值,之后减少,但没有被清除,而是持续存在。肝炎虽然逐渐好转,但发生了亚急性肉芽肿性浆膜炎,大多数IFN-γ缺损B6小鼠均死亡。另外,从发生亚急性肉芽肿性浆膜炎的IFN-γ缺损B6小鼠体内分离出了抗CTL病毒25V16G。
●在IFN-γ缺损B6小鼠腹腔内接种抗CTL病毒25V16G后,病毒在肝脏快速增殖,发生暴发性肝炎,小鼠死亡。
未来展望
查清传染病的病理发生机制是开发疫苗不可或缺的步骤,动物疾病模型有助于理解病理发生机制。研究认为,小鼠冠状病毒传染病为查清包括COVID-19在内的人类冠状病毒传染病的病理发生机制,尤其是病毒与宿主的免疫系统之间的相互作用提供了启发。针对COVID-19的疫苗目前正在开发中,能诱导病毒特异性CTL的疫苗被认为比较有希望。或许需要研究一下COVID-19是否也出现了在IFN-γ缺损B6小鼠体内发现的抗CTL性SARS-CoV-2。另外,如果存在合适的抗病毒药物,通过在急性期给患者用药抑制病毒增殖,也许可以抑制抗CTL性SARS-CoV-2的出现,这些都值得进行研究。
文献
文献1: Kyuwa, S. et al. 1996. Exp. Anim. 45: 81-83.
文献2: Yamaguchi, K. et al. 1991. J. Neuroimmunol. 32: 1-9.
文献3: Kyuwa, S. et al. J. Virol. 72: 9286-9290.
文献4: Kyuwa, S. et al. 2002. Virus Res. 83: 169-177.
文献5: Kyuwa, S. et al. 2010. Viral Immunol. 23: 437-442.
论文信息
题目:Role of cytotoxic T lymphocytes and interferon-γ in coronavirus infection: lessons from murine coronavirus infections in mice
期刊:Journal of Veterinary Medical Science
DOI:10.1292/jvms.20-0313
URL:https://www.jstage.jst.go.jp/article/jvms/advpub/0/advpub_20-0313/_article/-char/en
文:JST客观日本编辑部














