京都大学iPS细胞研究所(CiRA)的特定研究员赵成珠和池谷真副教授的研究团队,京都大学研究生院医学研究科整形外科的光泽定己研究生、池口良辅副教授和松田秀一教授的研究团队,以及京都大学研究生院医学研究科人类健康科学的青山朋树教授、佐贺大学医学部再生医学研究中心的中山功一教授和Cyfuse公司的代表董事秋枝静香通过开展联合研究,验证了利用人工多能干细胞(iPS细胞)源间充质干细胞(iMSC)制备的生物3D神经导管对末梢神经再生的有效性和机制。
研究团队将免疫缺陷大鼠的坐骨神经切断5mm进行了验证,虽然在作为生物3D神经导管移植的对照组使用的硅胶管移植中,切断的神经也在术后8周实现再生,但对形态、运动性、电生理学和肌肉重量进行评估发现,生物3D神经导管移植组的再生神经明显处于优势。另外,在移植的生物3D神经导管的内侧和表面都观察到了新生血管,确认iMSC的皮下移植具有促进血管新生的功能。
以上结果表明,利用iMSC制备的生物3D神经导管能有效实现末梢神经再生,将来有望为临床应用做贡献。
研究背景
外伤和肿瘤切除经常会损伤末梢神经。在可以缝合的情况下,一般通过缝合切断处进行修复,无法缝合时,最标准的治疗方法就是自体神经移植。移植的神经是轴突生长的最佳支架,能帮助修复受损的神经。不过,自体移植存在一些潜在的缺点,比如采集部位感染、供给量有限、会形成神经瘤、口径不一致、需要额外做外科手术以及手术时间增加等。
异体神经移植虽然能解决其中一些缺点,但需要在围手术期进行免疫抑制以及妥善保管采集的神经等。人工神经导管是第三个选项,已经实际用于临床。据报告,人工神经导管的支持细胞、支架、生长因子和血管生成能力等已得到改善,但由于使用人工材料,存在生物相容性差、排异反应和感染风险等课题。
为克服这些课题,本研究利用品质稳定、易于管理,而且理论上可以无限扩增培养的iPS细胞,诱导了有望分泌免疫调节分子和外泌体及修复受损组织等的间充质干细胞(iMSC),制备了神经导管。此次使用的iMSC是在神经嵴细胞(NCC)的介导下通过iPS细胞诱导为iMSC的,可以在各个阶段扩增培养、冷冻保存及评估品质,而且是通过排除了动物源成分的方法诱导的。考虑到未来的临床应用,这些特征被认为是巨大的优点。
研究结果
1. 生物3D神经导管的制备
首先在温度响应板上培养iMSC,生成细胞膜片,然后将细胞膜片转移到低粘性板上,制备块状iMSC(clump-iMSC, 以下简称C-iMSC,图1A、B)。利用生物3D打印机,将直径为500±50μm的C-iMSC配置在9×9的剑山上,并进一步培养,制备管状结构体(生物3D神经导管)。通过染色,确认C-iMSC及生物3D神经导管的iMSC周围存在细胞外基质(I型胶原蛋白,图1C)。对生物3D神经导管各个制备阶段的基因表达进行全面解析发现,iMSC、细胞膜片、C-iMSC及生物3D神经导管的基因表达模式与骨髓源间充质干细胞相似。
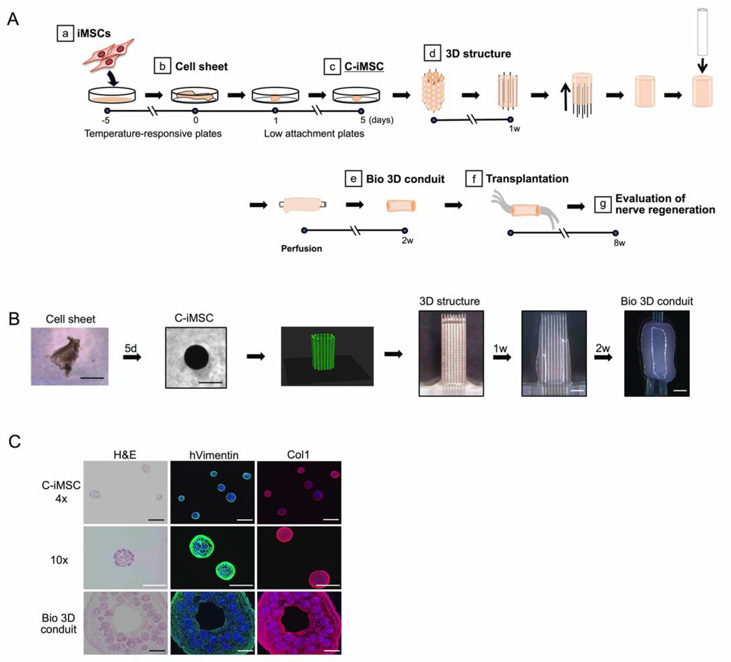
图1:利用不含动物源成分的iMSC制备生物3D神经导管
A:生物3D神经导管的制备方法
B:制备生物3D神经导管的各个阶段的图像
C:C-iMSC和生物3D导管的截面图像
Col1:I型胶原蛋白
2. 生物3D神经导管的移植
接下来,为调查生物3D神经导管的治疗效果,向大鼠的坐骨神经切断模型进行了移植。做完移植手术8周后进行肉眼观察,确认了导管的形态和对周围组织的影响。在生物3D神经导管移植组和作为对照组使用的硅胶管移植组,所有大鼠的切断神经都恢复了连接。另外,生物3D神经导管在8周后依然保持形状不变,有趣的是,表层明显观察到了新生血管。观察生物3D神经导管的横截面和纵截面发现,生物3D神经导管的中心部分有再生神经,其周围出现新生血管。而硅胶管移植组仅观察到了非常细的再生神经。
3. 再生神经的功能恢复
为调查生物3D神经导管移植组的功能恢复情况,研究团队实施了下述评估。
首先通过针刺测试评估了感觉神经的恢复情况。将痛觉刺激的程度分为1~3三个等级(3级反应最强烈),手术8周后,生物3D神经导管移植组的所有大鼠都被评为3级(图2A)。硅胶管移植组有1只大鼠被评为3级,5只大鼠被评为2级。两组均观察到感觉神经的功能恢复,但两组之间存在显著差异,生物3D神经导管移植组的感觉神经功能恢复得更好。
然后通过展趾测试评估了运动神经的恢复情况。将脚趾的伸展程度分为1~3三个等级(3级伸展最大),手术8周后,生物3D神经导管移植组有5只大鼠被评为3级,1只大鼠被评为2级(图2B)。而硅胶管移植组有1只大鼠被评为2级,3只大鼠被评为1级,2只大鼠被评为0级。两组之间存在显著差异,生物3D神经导管移植组的运动神经功能恢复得更好。
为评估行动功能的恢复情况,测量了在跑步机上走路时后肢的运动特性。关于平均拖足(DT)情况,生物3D神经导管移植组和硅胶管移植组之间没有显著差异(图2C)。生物3D神经导管移植组的足部仰角(AoA)比硅胶管移植组大(图2D)。
为确认新生长的轴突是否到达目标肌肉的神经肌肉接头,研究团队对足部的内收肌进行了电生理学研究。生物3D神经导管移植组显示出了远远高于硅胶管移植组的振幅(图2E)。平均运动神经传导速度(MNCV)也是生物3D神经导管移植组高于硅胶管移植组,不过差别并不明显(图2F)。这些数据表明,生物3D神经导管移植组的目标肌肉再次受到了强烈的神经控制。
最后,为检查末梢神经损伤引起的肌肉萎缩,测量了胫前肌的肌肉湿重。观察发现,肌肉重量也是生物3D神经导管移植组明显重于硅胶管移植组(图2G)。这表明,硅胶管移植组的肌肉萎缩更严重。生物3D神经导管移植组的肌肉萎缩程度较轻,因此从恢复的初期阶段开始,目标肌肉就再次受到了神经控制。
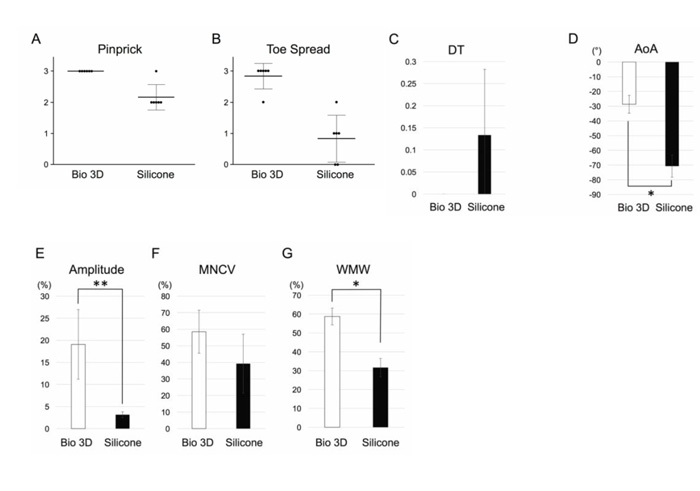
图2:手术后8周的功能恢复情况
A:针刺测试(感觉神经的恢复情况)
B:展趾测试(运动神经的恢复情况)
C:拖足(DT)
D:足部仰角(AoA)
E. F:电生理学解析
振幅(Amplitude)与运动神经传导速度(MNCV)
G:胫前肌的肌肉湿重(WMW)
4.再生神经的组织学解析
为评估再生神经,研究团队进行了组织学解析。
通过甲苯胺蓝染色法观察发现,生物3D神经导管移植组中央部分(图3A-a、c、e)的有髓轴突数量比硅胶管移植组(图3A-b、d、f)多。利用透射电子显微镜(TEM)观察确认,生物3D神经导管移植组存在带有形态正常的髓鞘的有髓轴突。另外发现,与硅胶管移植组相比,生物3D神经导管移植组的有髓轴突直径明显更大,髓鞘也更厚。除此之外还发现,生物3D神经导管移植组的G比(轴突直径÷髓鞘直径)明显小于硅胶管移植组。以上结果证明,关于再生轴突的形态,目前的生物3D神经导管(人iMSC)移植组在有髓轴突的量和质两方面都优于硅胶管移植组。
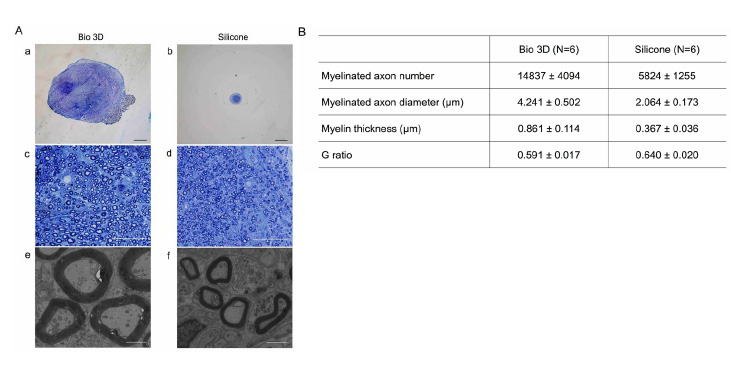
图3:再生神经的组织学解析
A:(a-d)光学显微镜下的横截面(甲苯胺蓝染色法),(e、f)透射电子显微镜的极薄横截面比例尺:(a、b)1000μm,(c、d)50μm,(e、f)2μm
B:生物3D神经导管移植组的髓鞘化轴突数量多,轴突直径大,髓鞘厚(P<0.01)
5.生物3D导管促进神经生长及促进血管生长的可能性
众所周知,MSC会生成各种分泌性因子。因此,研究团队评估了生物3D神经导管是否表达神经生长因子和血管生长因子。通过全面进行基因表达解析发现,各生物3D神经导管在各个阶段都表达与神经生成和血管生成有关的基因。另外,还通过RT-qPCR确认了与典型的神经生长(NGF、NRG1、TRAF6及HGF)和血管生长(VEGFA、VEGFB、ANGPT1及ANGPT2)有关的基因表达。这些数据表明,移植前的生物3D神经导管可能通过促进神经生长和促进血管生长的功能来支持神经再生。
6. iMSC生成新血管的可能性
由于生物3D神经导管表达血管新生促进因子,而且导管周围肉眼观察到了丰富的新生血管,因此研究团队在去端肽胶原海绵(Pelnac)中植入iMSC,并移植到大鼠皮下,进行了2周的观察(图4A)。植入iMSC的Pelnac移植组(iMSC移植组,图4A左)的新生血管总面积存在比Pelnac移植组(图4A中央)或硅移植组(图4A右)大的倾向(图4B)。观察发现,iMSC移植组的新生血管长度明显比Pelnac移植组及硅移植组的新生血管长(图4C)。最后评估了血管网的形成情况,研究团队观察到,iMSC移植组的新生血管封闭网络数量,远远高于Pelnac移植组和硅移植组的网络(图4D)。这些结果表明,皮下移植的iMSC比作为对照组(Pelnac组)的单独Pelnac更强烈地诱导了血管的稳定形成。
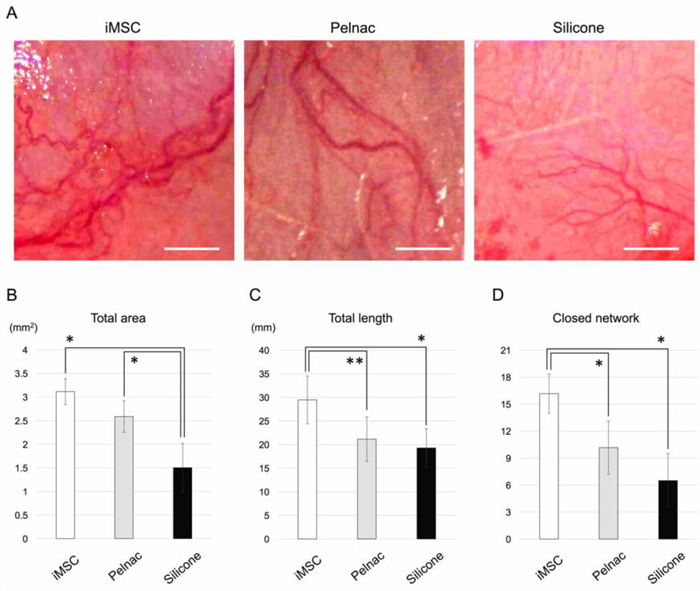
图4:皮下移植的新生血管分析
A:三个移植组在手术用显微镜下的肉眼照片,iMSC移植组的新生血管更多,比例尺为1mm
B:iMSC组的新生血管总面积(* P<0.01)
C:iMSC组的新生血管总长度(** P<0.05,* P<0.01)
D:iMSC组的新生血管封闭网络数量(* P<0.01)
结论
本研究验证了利用人iMSC(利用不含动物源成分的方法制备)制备的生物3D神经导管对末梢神经再生的有效性和机制。生物3D神经导管对末梢神经再生的有效性已通过成纤维细胞和牙龈源MSC确认过,但此次研究使用了iPS细胞源MSC(iMSC),就这一点而言比较新颖。
另外,通过以往的研究已经知道,切断神经周围新形成的血管成为雪旺细胞穿过切断部位的支架,为轴突再生提供了良好的环境。本研究确认,生物3D神经导管的内侧和外侧都形成了新的血管,另外还通过向大鼠进行皮下移植确认iMSC具有诱导血管新生的能力(图4)。以上结果表明,利用iMSC制备的生物3D神经导管可能在新生血管的介导下为末梢神经再生做出了贡献。
为推进临床应用,今后应该还需要进一步研究安全性、有效性和成本,不过此次的研究结果表明,源自iMSC的生物3D神经导管有望在神经缺损治疗中取代神经自体移植片。
论文信息
题目:Pro-angiogenic scaffold-free Bio three-dimensional conduit developed from human induced pluripotent stem cell-derived mesenchymal stem cells promotes peripheral nerve regeneration
期刊:Scientific Reports
URL:nature.com/articles/s41598-020-68745-1
文:JST客观日本编辑部














