京都大学的特定基地助教土井大辅(CiRA临床应用研究部门)和高桥淳教授(CiRA临床应用研究部门)组成的研究团队,确认了来自临床用人源iPS细胞的多巴胺神经祖细胞(DAP)的安全性和有效性,并确立了用于临床试验的品质标准(图1)。对DAP的特性进行体外(in vitro)解析发现,其不含未分化的iPS细胞和增殖性早期神经干细胞,癌症相关基因也没有出现异常。另外,利用免疫缺陷小鼠实施的体内(in vivo)试验也没有发现细胞的致瘤性和毒性。此外,将DAP移植到PD模型大鼠的纹状体发现,异常旋转运动得到改善。研究团队根据这些结果,于2018年针对PD患者启动了细胞移植治疗的临床试验(医生主导的临床试验)。
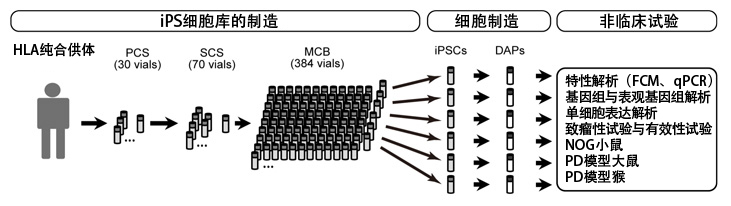
图1:研究流程概要
FCM:流式细胞术,qPCR:定量PCR
研究背景
帕金森症(PD)是中脑黑质-纹状体系统的多巴胺神经细胞脱落引起的神经退行性疾病,主要症状表现为动作迟缓、震颤和肌肉僵直等,日本目前大约有17万名患者。发病初期使用左旋多巴等药物治疗效果显著,但由于不是疾病的根本性治疗方法,随着病情的发展,效果会减弱并可能出现副作用。外科疗法有使用微电极的DBS(脑深部电刺激治疗),但从长期来看效果同样会减弱。通过移植来补充失去的多巴胺神经细胞的细胞移植治疗作为更有望实现根治的新疗法之一备受期待,在使用人类胎儿细胞的欧美临床试验中,部分病例取得了效果,包括运动症状得到改善、无需再进行药物治疗等。不过,胎儿细胞存在细胞供应问题和伦理问题,因此,人多能干细胞(ES细胞和iPS细胞)作为细胞来源备受期待,全球都展开了研究。
研究人员开发出了利用人多能干细胞制作多巴胺神经细胞的培养方法,在啮齿类和灵长类动物的PD模型上显示出有效性,研究已经进入可以临床使用的阶段。不过,使用多能干细胞进行细胞治疗的规则尚未在全球建立统一标准,目前各国都在根据各自的法律标准推进临床应用。澳大利亚和中国已开始使用人ES细胞对PD实施临床试验,京都大学的研究团队在日本启动了临床试验。要想使PD的细胞治疗实现标准化,共享非临床试验和临床试验的结果至关重要。在细胞移植治疗中,移植的细胞有望在脑内存活并作为多巴胺神经细胞工作,因此被认为需要进行严格的管理。这篇论文整理了为确认人源iPS细胞多巴胺神经祖细胞的安全性和有效性而实施的非临床试验的结果。
研究结果
1)来自人源iPS细胞的多巴胺神经祖细胞(DAP)制造工序(图2)
研究团队首先确立了制造临床用细胞制剂的工序。采用通过HLA纯合志愿者供体在京都大学iPS细胞研究所建立的iPS细胞库作为原料,制作了数百个主细胞库(MCB)。计划在为患者治疗时,解冻1瓶MCB并分化诱导DAP,然后无需冷冻直接用于移植,非临床试验也利用同样的方法解冻并分化诱导了25瓶MCB,确认了制造工序的再现性。分化诱导方法以此前开发的研究用分化诱导法为基础,将试剂、抗体和细胞分选仪变更成了可以临床使用的产品。
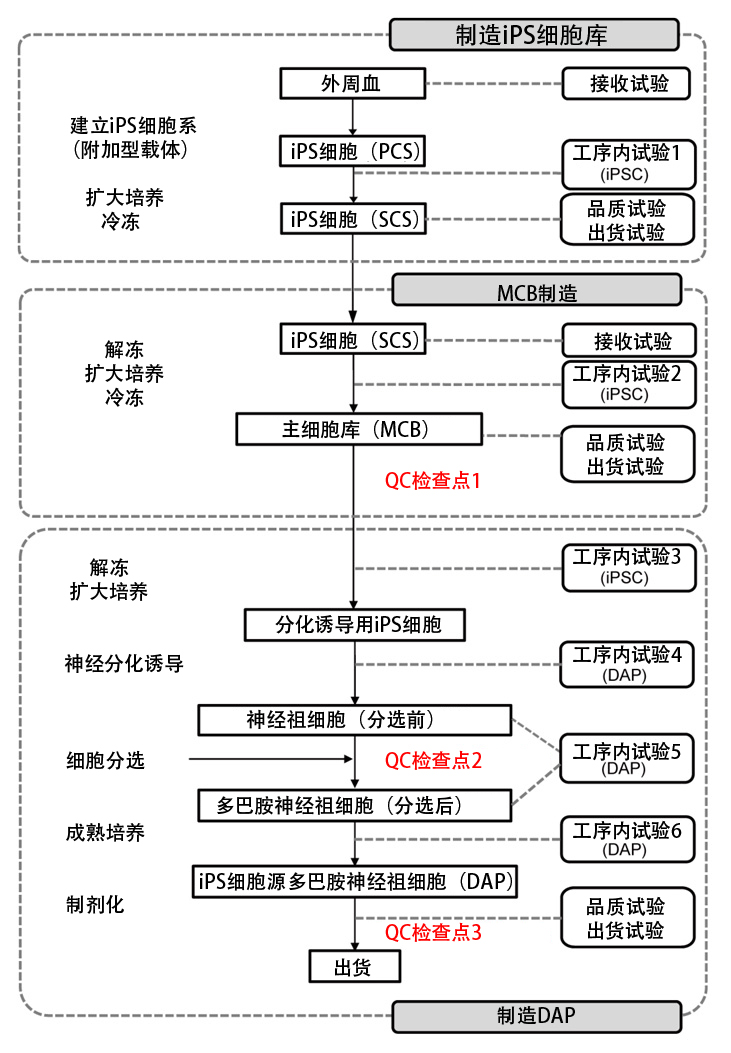
图2:人源iPS细胞多巴胺神经祖细胞(DAP)的制造工序
2)iPS细胞及最终产品的特性评估(图3)
作为分化诱导工序中的品质评估,设定了3个检查点(iPS细胞、细胞分选前后、最终产品)。首先,关于iPS细胞(MCB003)的品质评估,确认了群落形态以及TRA-1-60、TRA-2-49和SSEA-4等未分化细胞标志物,还确认了无菌性。DAP实施了25次分化诱导,在实施分化诱导第12天的细胞分选前后确认,分化标志物(CORIN)和未分化标志物(TRA-1-60)的表达量分别为10%以上和0.1%以下。关于最终产品的品质管理,在分化诱导第26天通过流式细胞术和定量PCR确认,DAP(FOXA2+TUJ1+)为主体(80%以上),不含未分化细胞(未分化iPS细胞:OCT3/4、TRA-2-49、LIN28、未分化神经干细胞:SOX1+PAX6+细胞)。另外,还通过测量释放到培养基中的多巴胺的量以及对自发动作电位进行电生理学解析确认,DAP分化为功能成熟的多巴胺神经细胞。
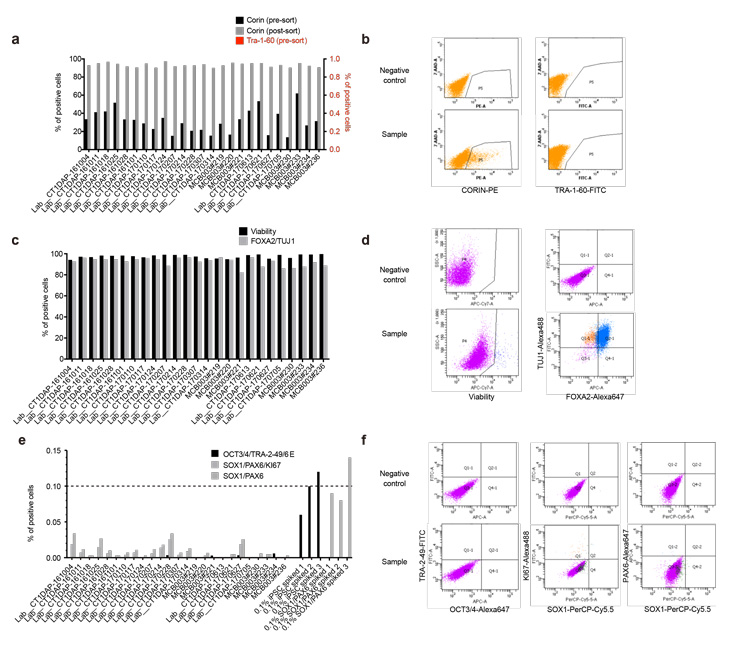
图3:基于流式细胞术的特性解析结果
a,b)实施分化诱导第12天的分化标志物和未分化细胞标志物的表达解析结果。c,d)实施分化诱导第26天的细胞存活率(Viability)及分化标志物(FOXA2/TUJ1)的表达解析结果。e,f)实施分化诱导第26天的未分化iPS细胞标志物(OCT3/4、 TRA-2-49/6E)及增殖性神经干细胞标志物(SOX1、PAX6、KI67)的表达解析结果。
3)基因组和表观基因组解析、单细胞解析(图4)
细胞制剂的基因组和表观基因组突变可能会影响移植后的细胞动作,因此评估了制造工序中的基因组和表观基因组的稳定性。研究团队实施6次分化诱导,对各iPS细胞以及分化诱导第12天和第26天的样本实施了全基因组解析(whole genome sequencing: WGS)及外显子组解析(whole exome sequencing: WES),并与培养iPS细胞的外周血细胞进行了比较。
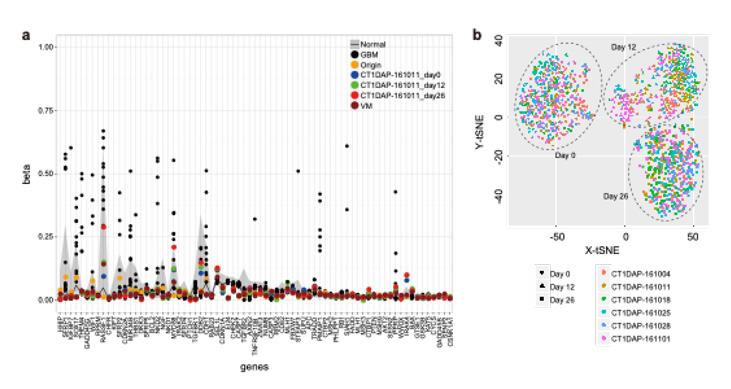
图4:a)甲基化解析结果及b)单细胞表达解析结果
GBM:glioblastoma multiforme 多态性胶质母细胞瘤,Origin:外周血单个核细胞(iPS细胞的原料),CT1-DAP:多巴胺神经祖细胞,VM:胎儿中脑腹侧组织
在基因组解析中未检测出癌症相关基因发生突变,在73个基因的甲基化解析中确认,与恶性脑肿瘤相比,甲基化水平较低,与胎儿组织和正常细胞为同等水平。
为确认细胞制造工序的再现性,研究团队对通过6次分化诱导制造的细胞的单细胞表达进行了解析。由此确认,通过6次分化诱导制造的细胞群显示出相同的分布,与多巴胺神经分化有关的基因表达在6次制造中均相同。
4)一般毒性及致瘤性试验的结果(图5)
研究团队利用与用于基因组和表观基因组解析的细胞相同的细胞,在GLP设施实施了一般毒性和体内分布试验及致瘤性试验。与医药品医疗机器综合机构(PMDA)进行讨论后,决定将观察期定为免疫缺陷小鼠(NOG小鼠)的存活期间,计划对至少10只小鼠进行组织学评估,并为80只小鼠(对照组:50只)移植iPS细胞。移植52周后,由于寿命原因,对照组的雄性小鼠减少至19只,因此结束观察,并进行了组织学评估。利用苏木精-伊红(H-E)染色法未见组织学恶性发现和增殖图像,确认多巴胺神经细胞顺利存活。根据这些结果,可以认为细胞制剂没有致瘤性。另外,接受移植的动物未发现因细胞移植而引起的异常,人源细胞仅存在于脑内,未发现向其他器官转移。
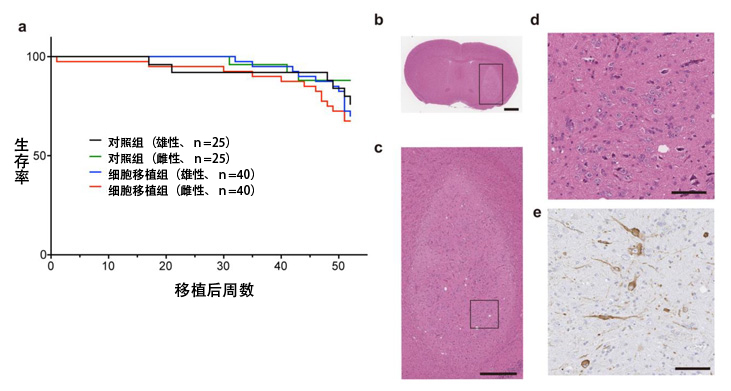
图5:致瘤性试验结果
a)免疫缺陷小鼠的生存曲线。b-d)实施细胞移植的小鼠脑切片的H-E染色,e)TH(酪氨酸羟化酶、多巴胺神经标志物)的免疫染色图像。
为检测混入的未分化iPS细胞,研究团队向NOG小鼠皮下移植了包埋在基质胶中的最终产品,以及在最终产品中添加了0.001~10%的未分化iPS细胞的细胞(对照组)。作为阳性对照组的HeLa细胞和其他iPS细胞系形成了皮下肿瘤,而最终产品及添加未分化iPS细胞的对照组均未形成皮下肿瘤,确认产品中未混入未分化的iPS细胞,而且即使混入也不会形成肿瘤。
5)有效性试验的结果
为确认有效性,向利用6-OHDA(6-羟基多巴胺,6-hydroxydopamine)使单侧多巴胺神经细胞脱落的PD模型大鼠移植了最终产品。移植后16周,甲基苯丙胺给药后异常旋转运动恢复正常,在纹状体内确认多巴胺神经细胞成功存活,神经突起伸展。
研究意义与今后的课题
通过此次研究确认了来人源iPS细胞的多巴胺神经祖细胞的安全性和有效性。根据该结果,得到了PMDA及京都大学医学部附属医院临床试验审查委员会的批准,在京都大学医学部附属医院启动了由医生主导的临床试验(针对帕金森症,来自人源iPS细胞的多巴胺神经祖细胞的细胞移植安全性和有效性医生主导临床试验,第I/II期)。关于多能干细胞源细胞制剂的非临床试验,尤其是致瘤性试验计划和基因组解析的利弊,意见尚未达成一致,通过积累此次这种非临床试验的结果,有望推进试验标准化的讨论。
论文信息
题目:Pre-clinical study of induced pluripotent stem cell-derived dopaminergic progenitor cells for Parkinson's disease
期刊:《Nature Communications》
URL:nature.com/articles/s41467-020-17165-w
文:JST客观日本编辑部














