日本东京医科齿科大学生体材料工学研究所有机生体材料学专业的西田庆博士、田村笃志副教授和由井伸彦教授等人组成的研究团队,于全球率先设计出了使超分子聚合物聚轮烷与靶向癌症的抗体结合的“抗体-超分子结合体”,成功克服了对癌细胞没有选择性以及难以吸收进细胞内的问题。
【研究背景】
聚轮烷是高分子贯穿环状糖类环糊精空腔部的超分子聚合物,作为入选2016年诺贝尔化学奖的分子机器的代表一直备受关注。近年来推进了将源自聚轮烷独特结构的物理特性应用于材料的研究,以及在医药材料和生物材料方面的用途。研究团队此前于全球率先发现,含有甲基化β-环糊精(Me-β-CD)的聚轮烷(Me-PRX)会在细胞内分解并释放Me-β-CD,从而诱导自噬细胞死亡。Me-PRX引起的自噬细胞死亡对于已经对其他细胞死亡——细胞凋亡获得抗性的细胞也有效,在癌症治疗方面的应用备受期待。不过,这种方法存在对癌细胞没有选择性,以及难以被吸收到细胞内的问题。
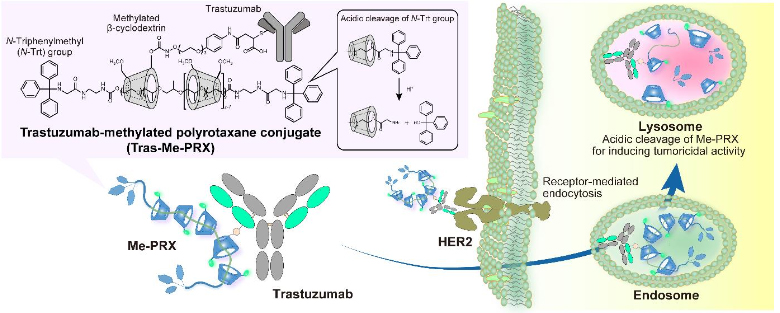
图1:抗体-超分子结合体(Trasutuzmab-Me-PRX)的结构以及对细胞的作用
研究成果
在此次的研究中,为了实施使Me-PRX积极靶向癌细胞,并通过Me-PRX选择性地诱导自噬细胞死亡的分子设计,研究团队提出了使癌细胞抗体与Me-PRX结合的抗体-超分子结合体(图1)。抗体-超分子结合体有望通过抗体识别癌细胞,选择性地被吸收到细胞内。抗体选择了已知在恶性肿瘤中大量表达的HER2抗体Trastuzumab(Herceptin),合成了Trastuzumab-Me-PRX结合体(Tras-Me-PRX)。
为了评估Tras-Me-PRX被吸收到细胞内的情况,研究团队采用BT-474细胞作为HER2阳性细胞系、HeLa细胞作为HER2阴性细胞系,通过荧光显微镜(共聚焦显微镜)观察了利用荧光标记的Tras-Me-PRX(图2),在荧光标记的Tras-Me-PRX在BT-474细胞的表面和内部确认到了荧光,由此确认,这种结合体识别了细胞表面的HER2并与其结合,而且被吸收到细胞内。
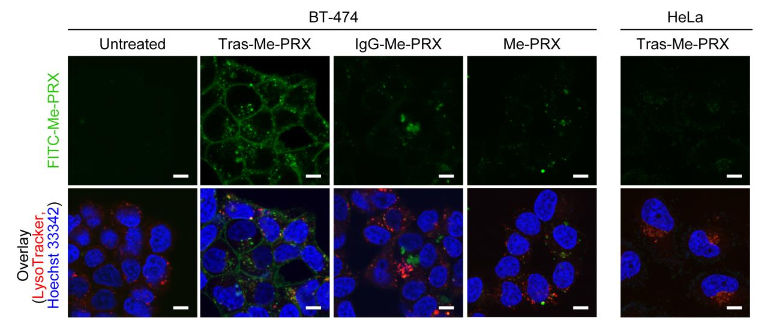
图2:针对HeLa细胞和BT-474细胞的FITC标记Tras-Me-PRX、IgG-Me-PRX和Me-PRX的亚细胞定位(24小时,scale bars = 10μm)
另一方面,与不具备HER2识别能力的IgG结合的IgG-Me-PRX和Me-PRX单体则未在细胞表面观察到荧光。HeLa细胞也没有在细胞膜表面和内部观察到荧光标记的Tras-Me-PRX。根据荧光强度评估荧光标记Tras-Me-PRX的吸收量发现,与Me-PRX单体相比,结合体的吸收量是其6~19倍。评估Me-PRX引起的细胞死亡发现,与Me-PRX相比,Tras-Me-PRX的半致死浓度(IC50)只有其10~60分之1(图3)。估计这是因为抗体提高了被细胞吸收的效率。
以上结果表明,本次研究提出的抗体-超分子结合体的概念有望用作癌症化学疗法的新平台。
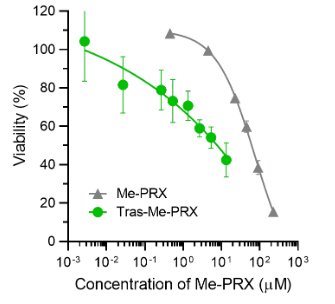
图3:Tras-Me-PRX和Me-PRX发挥作用后的BT-474细胞的存活率(72小时)
研究成果的意义
此次设计的抗体-超分子结合体的功能有望成为已获得治疗抗性的癌细胞化学疗法的新药物形态之一。另外,从材料科学的角度来看,抗体-超分子结合体的设计及证明其有效性的研究史无前例,应该可以定位为关注度非常高的研究。
论文信息
题目:An antibody–supermolecule conjugate for tumor-specific targeting of tumoricidal methylated β-cyclodextrin-threaded polyrotaxanesr
期刊:《Journal of Materials Chemistry B》
URL:pubs.rsc.org/en/content/articlelanding/2020/tb/d0tb00575d#!divAbstract
文:JST客观日本编辑部














