横滨市立大学研究生院医学研究科器官再生医学领域的谷口英树教授和关根圭辅客座副教授等人组成的研究团队,与东京大学医科学研究所和荣研化学公司等合作,开发出了在利用人iPS细胞分化诱导肝脏细胞等各种细胞时,可高灵敏度地检测出可能会微少残留的未分化iPS细胞的方法。
研究背景
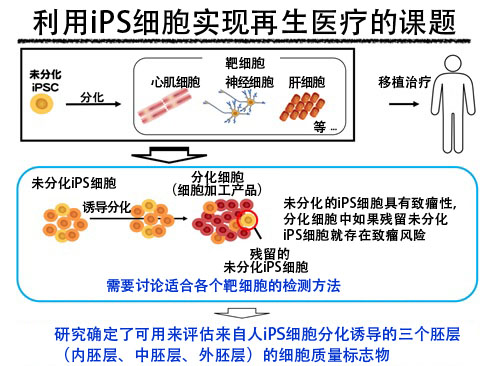
用于再生医疗的人iPS细胞分化诱导的功能细胞(器官细胞)很难做到所有细胞完全分化,可能会存在一些未分化的iPS细胞。未分化的iPS细胞移植到体内可能会形成畸胎瘤,为患者移植功能细胞前,需要评估混入未分化iPS细胞的可能性。目前,研究团队的目标是将2013年确立的迷你肝脏培养技术应用于再生医疗,但肝脏的再生医疗需要移植大量细胞,因此需要一种能在培养过程中以高灵敏度快速检测未分化iPS细胞的方法。
此前报告过几种评估混入的未分化iPS细胞的方法,所以研究团队尝试利用这些评估法使用的标记基因,但发现这些标记基因在肝脏的正常发育过程中也会表达。因此,利用人iPS细胞进行分化诱导时,无法区分是作为正常的肝细胞表达,还是混入了未分化的iPS细胞,所以标记基因并不适合作为评估方法使用。
此次以之前研究人iPS细胞源迷你肝脏获得的单细胞水平全基因表达信息为基础,开发出了适合评估迷你肝脏品质的方法。
研究内容
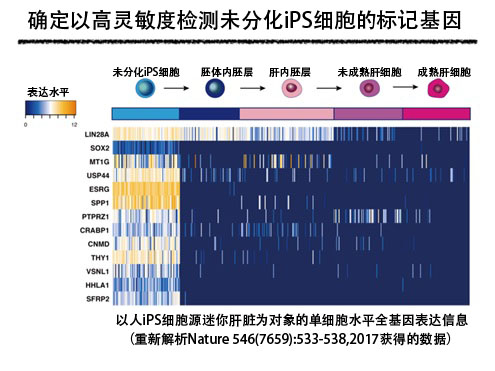
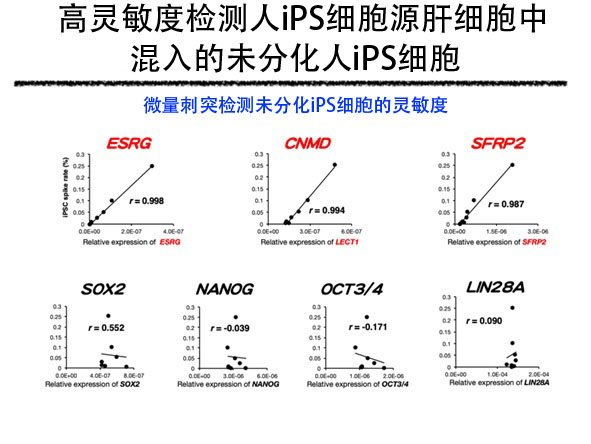
首先,研究团队重新解析了此前研究人iPS细胞源迷你肝脏时获得的单细胞水平全基因表达信息,作为可检测混入分化细胞中的未分化iPS细胞的标记,提取出12种在未分化iPS细胞中的表达水平格外高、而在分化细胞中的表达减少的基因。研究团队详细解析了这12种基因的基因表达,并实施了在分化细胞中混入未分化iPS细胞后检测混入的未分化iPS细胞的试验等,发现ESRG、CNMD和SFRP2三种基因在人iPS细胞源肝细胞中混入未分化iPS细胞时,能以高灵敏度检测出,可用来评估再生医疗用细胞的品质。人iPS细胞源迷你肝脏除肝细胞外,还使用人iPS细胞源血管内皮细胞和人iPS细胞源间充质细胞,因此研究团队还考虑了是否也能用来评价这些细胞中混入的未分化iPS细胞。研究发现,在人iPS细胞源血管内皮细胞和人iPS细胞源间充质细胞中,也能用来高灵敏度检测混入的未分化iPS细胞。
脊椎动物在发育初期会形成内胚层、中胚层和外胚层三种胚层(三胚层),其中,内胚层发育形成肝脏、肺、肠和胰脏等,中胚层形成血管、间充质细胞和心肌细胞等,外胚层形成神经和皮肤等。本次研究确定的标记基因在源自内胚层的细胞(肝脏、胰脏)和源自中胚层的细胞(血管内皮细胞、间充质细胞)中有效,因此研究团队又研究了在源自外胚层的细胞——神经细胞中是否有效。研究发现,在人iPS细胞源神经细胞中,也能以高灵敏度有效检测出混入的未分化iPS细胞。这些结果表明,本研究确定的标记基因在实现采用人iPS细胞的再生医疗时,不仅是人iPS细胞源迷你肝脏,还有望用来评价各种器官的细胞品质。
通过用本次研究开发的技术评估再生医疗用迷你肝脏培养过程中的品质,可以显著降低因混入未分化iPS细胞而产生的致瘤风险,能大幅提高移植患者的临床安全性。另外,不仅是迷你肝脏,该技术还有望用来评价采用人iPS细胞的其他细胞、组织和器官的培养过程中的品质。目前正通过产学合作的方式推进该技术的发展,开发旨在进一步提高检测灵敏度和检测精度的技术。
用语解说
迷你肝脏:通过以最佳比例混合利用人iPS细胞分化诱导的肝内胚层细胞、血管内皮细胞和间充质细胞,在体外培养条件下自主创造的肝脏基础——立体肝芽(迷你肝脏)。另外据报告,通过将这种创新的三维培养技术(器官原基法)应用于其他器官的培养,不仅是肝脏,还利用从胰脏、肾脏、肠、肺、心脏和脑分离的细胞制造了三维器官原基。制造的三维器官原基能在移植后立即重建具有血流的血管网络,并自主形成功能性组织。
■论文信息
题目:Robust detection of undifferentiated iPSC among differentiated cells
期刊:《Scientific Reports》
URL:nature.com/articles/s41598-020-66845-6
文:JST客观日本编辑部














