日本国立研究开发法人量子科学技术研究开发机构量子医学医疗部门放射线医学综合研究所先进核医学基础研究部门的博士研究员胡宽,部长张明荣教授等人与与美国哈佛大学布莱根妇女医院Wei Tao教授课题组,中国暨南大学王璐教授课题组和哈佛大学麻省总医院Steven Liang 教授课题组合作,开发成功了一种新的基于BPNS的光热剂,为兼具良好的“光热稳定性”和“快速降解性能”提供了一种可行的解决方案。该最新成果发表在《自然》子刊《Nature Communications》,题为“Marriage of black phosphorus and Cu2+ as effective photothermal agents for PET-guided combination cancer therapy”。
【开发背景】
作为一种微创、精确可控和治疗效果良好的治疗模态,光热治疗(PTT)-一种利用光热材料将光能转化为局部过热,从而杀死癌细胞的治疗方式,近年来在前临床和临床实践中获得了可喜的成就。在最近的一项临床前瞻性实验中,美国科学家将金-硅纳米壳 (gold-silica nanoshells, GSN)用于局部热消融前列腺内的低中度肿瘤,结果鼓舞人心—— 在94%(15/16)的患者中成功实现了GSN介导的聚焦激光消融,并且展现出良好的安全性。此外,氧化铁纳米颗粒 (NanoTherm, Magforce)已在欧洲被批准用于临床光热治疗。由于上述临床应用方面的显著进展,使得肿瘤光热治疗成为一种前景巨大的治疗模式,将对癌症的临床治疗实践产生重要的意义。
尽管如此,作为光热治疗的基石和关键组成部分——光热剂(PTA),仍然存在着不足和改善的空间。一种理想的光热剂必须同时满足多个条件,其中就包括: (1) 优良的光热转换效率和光热稳定性;(2)快速的体内降解并被代谢排出体内,以降低潜在的副作用。目前报道的光热剂,如无机纳米材料,具有很高的光热稳定性和光热转化效率,然而,这些纳米颗粒很难被活体代谢,通常在体内停留数月甚至更长时间,带来了相应的安全隐患。还有一些其他的有机光热分子,如吲哚菁绿(ICG),虽然表现出令人满意的生物安全性,但是,快速的体内清除使得它们的光热稳定性难以满足临床光热治疗的需求。此外,频繁的施加激光照射,将进一步加速有机光热剂的降解。虽然光热稳定性的问题可以通过提升注射剂量来解决,但是,这也将导致更高的代谢器官(如肝脏和肾脏)负荷,从而引发新的临床问题。上述大多数传统光热剂在“光热稳定性”和“快速降解”两方面的互不兼容的矛盾,是目前发展光热疗法亟需解决的瓶颈问题。
如果将光热剂的“光热稳定性”和“快速降解性”比作硬币的两面,那么,如何通过巧妙的设计,使硬币“站立”,同时展现出优良的光热稳定性和快速降解性,从而实现“理想”的光热治疗,是目前该领域尚未解决的重要科学问题。黑磷纳米片(BPNS),是一种生物兼容且可降解的二维纳米材料。作为一种光热剂,目前已被广泛应用于前临床肿瘤光热治疗。但是,BPNS是一种对水-氧环境易感的材料,在体内会快速被降解成磷氧化合物(PxOy), 从而失去光热治疗性能。尽管目前已有多种通过对BPNS进行共价或者非共价的修饰方法来对黑磷的光热稳定性进行改善,但是,这种改善是以损失优异的降解性能作为代价。如何在不损失BPNS的降解性能的基础上,提升BPNS的光热性能和治疗效果,从而实现“鱼和熊掌” 兼得,是科学家追求的目标之一。
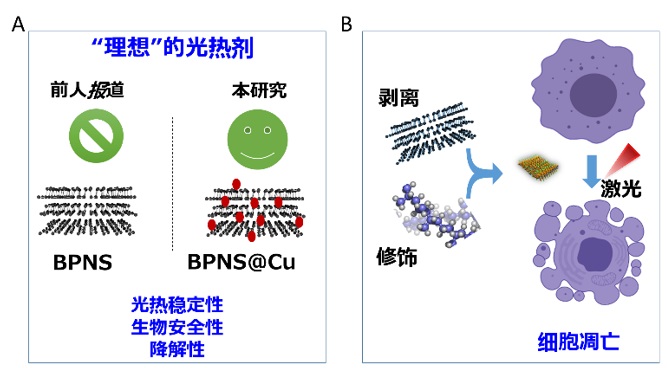
图一. 研究出发点和研究内容示意图
【研究方法和成果】
研究人员将二价金属铜离子(Cu2+)与BPNS进行有机结合,实现了“一举多得”的效果。该设计的优势主要表现为: (1) BPNS可以高效负载Cu2+; (2)基于Cu的纳米材料(如硫化铜纳米颗粒)是良好的光热剂,因此,BPNS 与 Cu 可以实现协同光热作用,进一步提升光热治疗性能;(3)Cu(II) 可以与P(0) 发生氧化还原反应,从而促进BPNS的降解;(4)反应生成的Cu(I)离子是一种类Fenton 反应催化剂,可以与肿瘤微环境中的H2O2发生反应,从而产生高浓度的•OH自由基,杀伤癌细胞,进而实现化学动力学治疗(Chemodynamic therapy)联合的光热治疗; (5) Cu-64是一种常用的对纳米药物进行示踪的正电子发射核素,可以用于正电子发射断层扫描成像(PET)和b-线治疗,目前已用于多项临床研究。
本设计中,研究人员通过对BPNS进行Cu-64标记,不会改变纳米药物的本来的结构,从而实现了对纳米药物精准的体内动态和代谢的示踪和反映。与传统的光学成像(如近红外,光声成像)相比,具有可全身动态监测,定量计算,临床实践零距离等多方面的优势,为未来基于BPNS的纳米药物的临床转化奠定了基础。
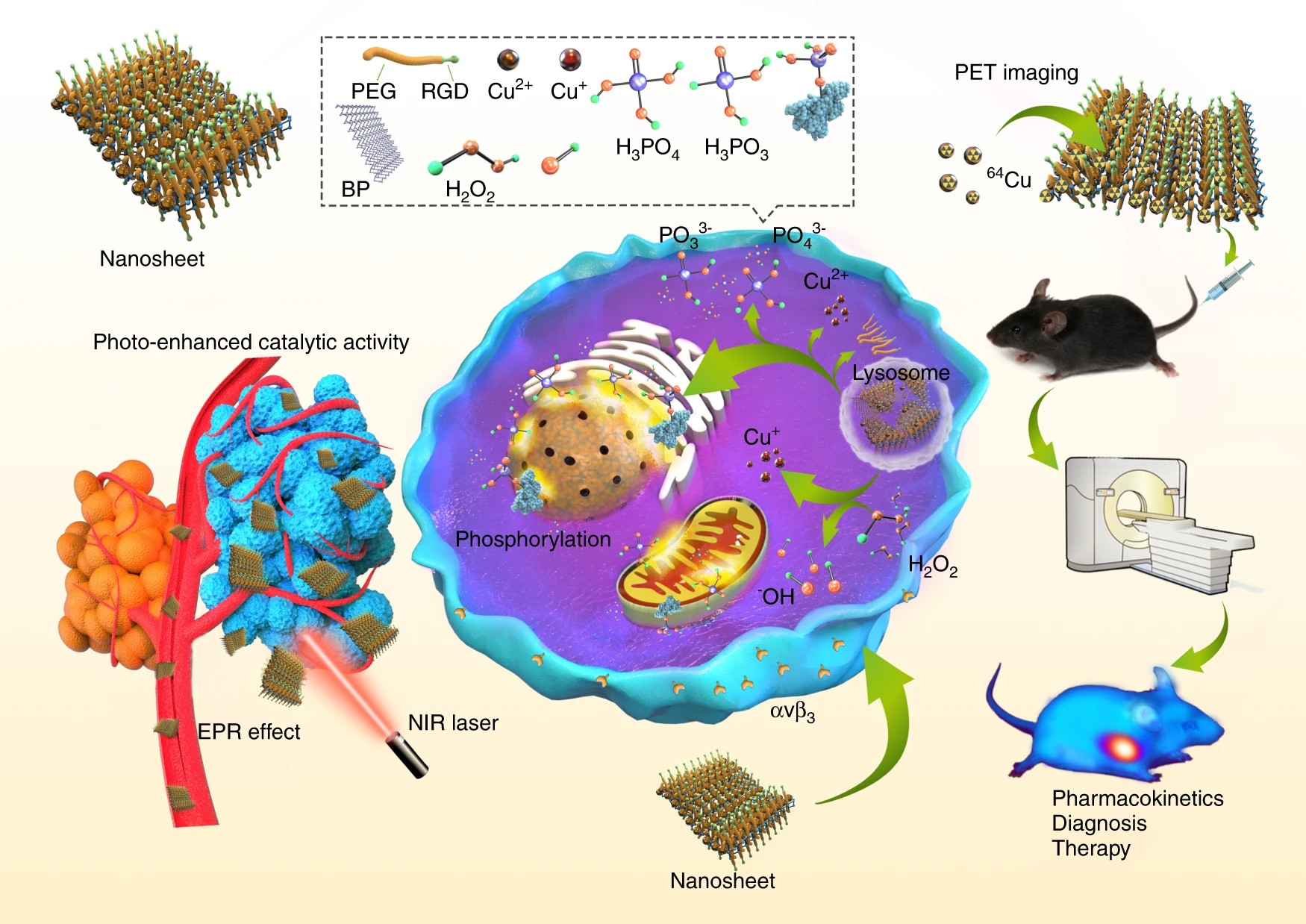
图二. 基于BP@Cu的纳米药物的光热治疗研究示意图。
在实验结果部分,研究人员首先研究了BPNS与Cu(II)之间的相互作用,通过一系列表征手段,如TEM, AFM, UV-VIS-IR,Raman, XPS, EPR等,证实了BPNS 与 Cu(II) 发生了氧化还原反应,生成了Cu(I)。随后,研究了BP@Cu 复合材料的光热性能,结果表明:Cu(II)与BPNS 产生了光热效果协同作用,在808 nm的激光照射下,BPNS@Cu释放出更多的热量。为了提升BP@Cu的体外稳定性,研究人员进一步用PEG对BP@Cu进行了包裹,并在表面修饰了整联素蛋白(integrin avb3)的靶向多肽(cyclo-RGD)。随后,研究人员选取了多种肿瘤细胞对BP@Cu@PEG-RGD的生物学效应进行了评价。结果显示:负载了Cu(II)的BPNS具有比BPNS更好的癌细胞杀伤效果。在随后细胞作用机制研究中,研究人员证实了BP@Cu诱导了癌细胞内更高的活性氧(ROS)水平,从而使癌细胞发生凋亡和细胞周期抑制。

图三. 原子力显微镜对合成的BP@Cu纳米片进行表征:黑磷-铜纳米片诱导癌细胞发生凋亡。
完整的体内药代动力学和代谢排泄途径的研究,是纳米药物进行临床实验前不可缺少的重要一环。日本国立放医研先进核医学研究部(部长张明荣教授)在过去数十年,专注于PET药物的开发和临床转化。在Cu-64标记的药物方面,目前有多种新药正在进行临床实验。基于该部门丰富的药物转化经验和完备的放药生产转化平台,研究人员对BPNS的体内分布,动态,肿瘤富集能力,排泄途径进行了全面的评价。与其他纳米药物类似,BP@Cu@PEG-RGD 通过尾静脉注射以后,会迅速被肝脏和脾脏吸收,但是随着BPNS的缓慢降解,这些纳米药物的尺寸会逐步缩小,并最终从脾脏和肝脏逃逸,重新进入血液循环。最终随着不断降解,部分BPNS将会被肾脏-膀胱通路排出体内。研究人员还考察了BP@Cu@PEG-RGD的肿瘤富集能力。在多种皮下肿瘤模型中,BP@Cu@PEG-RGD展现出在肿瘤组织的不断累积作用,并在18小时左右达到最高点。这些结果为随后施加光热治疗和制定给药方案提供了重要的参考。
最后,研究人员研究BP@Cu纳米药物的肿瘤治疗效果。结果表明,通过尾静脉注射纳米药物,并在808 nm 激光的照射下,BP@Cu0.4@PEG-RGD 治疗的肿瘤几乎被完全抑制。形成鲜明对比的是,BP@Cu0.4 以及BP@Cu0.4@PEG 治疗的肿瘤治疗效果不佳。这是由于BPNS 在肿瘤部位的富集主要是由RGD 介导。最终,研究人员用PET评价了治疗效果,并进一步强调了PET作为诊断方法在纳米药物开发和治疗效果评价方面的重要作用。
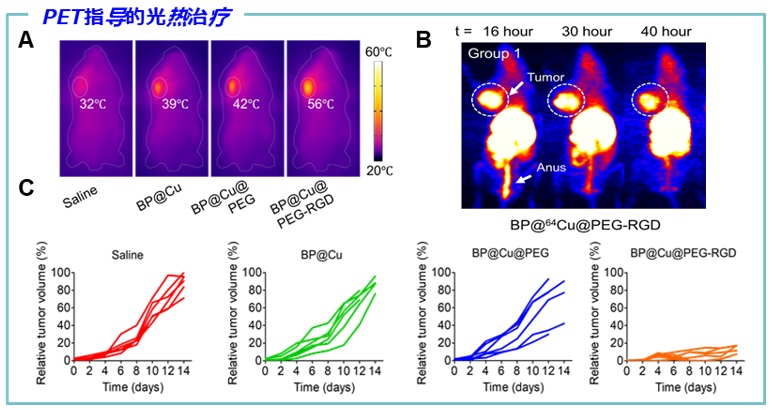
图四. (A)小鼠的近红外热成像照片。(B) 小鼠的PET图像。(C)小鼠的肿瘤生长曲线。
通过该项研究,研究人员针对目前光热剂存在的不足,提出了一种新的提升BPNS 光热治疗效果的方案,尝试开发一种理想的光热剂-兼具良好光热稳定性和降解性能的纳米药物,并通过PET成像,确定了治疗效果,为今后推动BPNS的临床应用打下了坚实的基础。
【论文信息】
题目:Marriage of black phosphorus and Cu2+ as effective photothermal agents for PET-guided combination cancer therapy
杂志:Nature Communications
doi.org/10.1038/s41467-020-16513-0
文:胡宽
编辑修改:JST 客观日本编辑部