日本理化学研究所(简称“理研”)生命医科学研究中心免疫转印控制研究团队的Wooseok Seo研究员与谷内一郎组长等人,查清了控制细胞迁移的分泌蛋白“趋化因子”——“CCL5”的表达抑制机制,同时还发现,CCL5的表达量会控制免疫细胞的功能,大大影响癌症免疫反应。
这项研究成果有望通过抑制CCL5的活性为开发新的癌症免疫疗法做贡献。
CCL5通过控制免疫细胞向炎症部位迁移的过程来调整免疫反应。近年来有报告显示,CCL5还参与了对癌细胞的免疫反应,但完全不清楚CCL5的表达是如何调整的。
此次,国际联合研究团队发现,RUNX转录因子会抑制CCL5基因的表达。通过详细调查其分子机制,确定了正调控CCL5基因表达的两个增强子。另外,通过利用基因编辑技术培育这两个增强子缺损的小鼠并进行解析发现,增强子缺损小鼠因CCL5的表达量降低,自然杀伤细胞(NK细胞)的功能增强,由此促进了癌细胞的排除。这些结果证明了一个新发现,即CCL5通过调控免疫细胞的功能状态来调整癌症免疫反应。
与野生型小鼠相比,CCL5近端增强子缺损小鼠抑制了癌症转移灶的形成
研究背景
“趋化因子”是促进细胞迁移(细胞趋化性[Chemotaxis])的分泌蛋白,具有将免疫细胞引导至病原微生物的感染部位并促进免疫反应的作用。趋化因子有很多种类型,“CCL5”是名为CC趋化因子的趋化因子家族的一员,作用于表达其受体CCR5的细胞。例如,发生炎症时,被激活的杀伤性T细胞和自然杀伤细胞(NK细胞)等免疫细胞就会产生CCL5,将表达受体CCR5的其他免疫细胞引导至发炎部位。
最新研究显示,趋化因子在针对癌细胞的免疫反应中也发挥着重要作用,CCL5在癌症免疫反应中的功能也受到关注。CCL5的表达量通过调整CCL5基因的表达控制,但此前一直不清楚CCL5基因的表达是如何控制的,尤其是不清楚是否存在抑制CCL5基因表达的机制。
长期研究“RUNX”转录因子的功能的谷内一郎组长等人此前报告,RUNX会抑制免疫细胞产生白细胞介素-4(IL-4),从而抑制过敏反应)。此次,国际联合研究团队试着探索了通过RUNX抑制产生的分泌蛋白。
研究方法与成果
RUNX转录因子可通过识别靶基因周边存在的调控基因组区域的特异性DNA序列并与基因组DNA结合,来诱导或抑制靶基因表达。国际联合研究团队首先通过基因修饰制作了RUNX转录因子功能缺损的小鼠。从该小鼠体内提取杀伤性T细胞进行培养并刺激后,调查了培养液中的分泌蛋白的量,发现与野生型小鼠的杀伤性T细胞相比,RUNX缺损杀伤性T细胞过度表达CC趋化因子家族、尤其是CCL5(图1)。这表明,CCL5的表达被RUNX抑制。
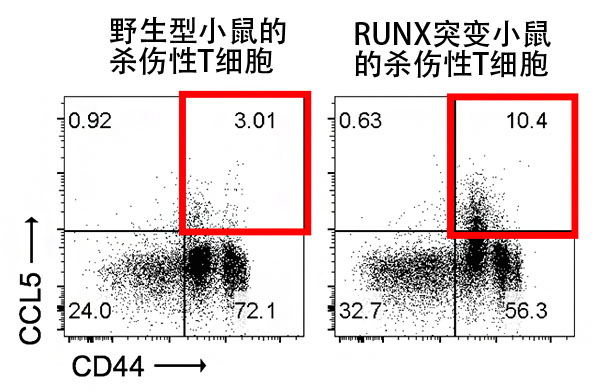
图1:培养杀伤性T细胞后解析CCL5的表达
与野生型小鼠的杀伤性T细胞相比,RUNX缺损杀伤性T细胞的CCL5表达增强。由此可见,CCL5的表达被RUNX抑制。
为调查RUNX转录因子如何抑制CCL5的表达,研究人员利用抗RUNX抗体染色质免疫沉淀法,在CCL5基因周边探索了RUNX转录因子结合的基因组区域。最终在CCL5基因上游5kb(千碱基=1,000碱基对)的位置发现了RUNX结合区域,并将该区域命名为“CCL5近端增强子”。
为调查CCL5近端增强子的功能,国际联合研究团队利用基因编辑技术制作了CCL5近端增强子缺损的小鼠。CCL5由感染或发炎时被激活的免疫细胞分泌,但在没有感染或发炎的稳定状态下,驻留在粘膜等外周组织的组织驻留记忆T细胞也会少量产生CCL5。已知这种稳定状态下的CCL5表达在维持外周组织中的免疫细胞方面发挥着重要作用。令人吃惊的是,在CCL5近端增强子缺损小鼠体内,稳定状态下的CCL5表达消失,但被激活的杀伤性T细胞的CCL5表达未见变化。这个结果表明,其他部位可能也存在诱导CCL5基因在被激活的杀伤性T细胞中表达的增强子。
因此,国际联合研究团队利用最新研究方法(采用名为enChIP的CRISPR/Cas9技术),全面探索了与CCL5基因相互作用的基因组区域。最终成功确定了在距离CCL5基因1.35Mb(兆碱基=100万碱基对)的极远端置存在的另一个增强子区域,并将该区域命名为“CCL5远端增强子”。RUNX转录因子还与CCL5远端增强子结合,在CCL5远端增强子缺损的小鼠体内,被激活的杀伤性T细胞的CCL5基因表达消失。
这些结果表明,CCL5基因表达至少受近端增强子和远端增强子这两种增强子控制,RUNX转录因子拮抗性作用于这两种增强子,抑制了CCL5基因的表达(图2)。此次还是首次确定CCL5基因的增强子,也是首次确认存在主动抑制CCL5基因表达的机制,可以说是一项划时代的成果。
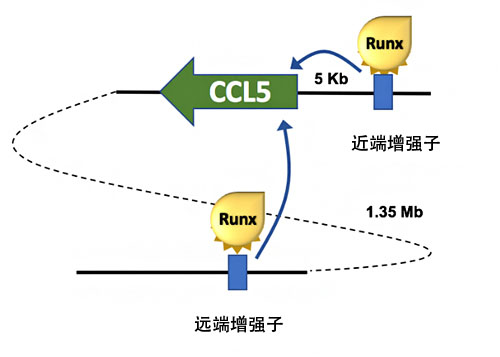
图2:调整CCL5基因表达的两种增强子
CCL5基因5kb上游处存在近端增强子,1.35Mb远处存在远端增强子,均被RUNX转录因子抑制了功能。
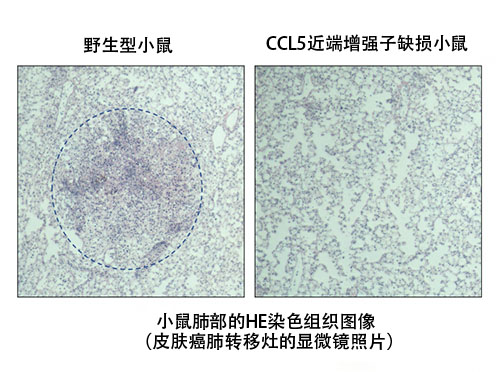
近年来的研究成果表明了组织驻留型免疫细胞在癌症免疫反应中的重要性。另外还发现,CCL5对维持组织驻留型免疫细胞至关重要。因此,国际联合研究团队利用此次制作的CCL5的两个增强子缺损的小鼠和皮肤癌细胞肺转移模型小鼠,调查了癌症免疫反应。结果显示,CCL5近端增强子缺损小鼠抑制了癌细胞肺转移观察到的癌细胞转移灶的形成,也就是说,有效排除了癌细胞(图3)。
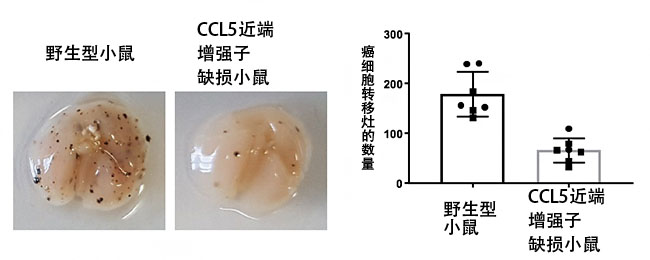
图3:利用皮肤癌细胞肺转移模型小鼠的癌症免疫解析结果
左为小鼠肺部照片,黑点表示皮肤癌细胞的肺转移灶。可以看出,与野生型小鼠相比,CCL5近端增强子缺损小鼠抑制了癌细胞转移灶的形成,排除癌细胞的癌症免疫反应增强。
已知在针对皮肤癌细胞肺转移的癌症免疫反应中,NK细胞发挥着重要作用。因此,国际联合研究团队利用名为RNA-seq的研究方法解析了NK细胞的功能。结果发现,因近端增强子缺损导致肺部的CCL5表达量减少,驻留肺部的NK细胞大量表达了与攻击癌细胞的功能有关的基因(图4)。这个结果表明,CCL5除诱导细胞迁移的经典功能外,还具有新功能,可调整正常时驻留组织中的免疫细胞的功能,并调节对癌细胞的免疫反应。研究认为,RUNX转录因子通过拮抗性作用于CCL5的增强子,防止CCL5过度表达来增强癌症免疫反应。
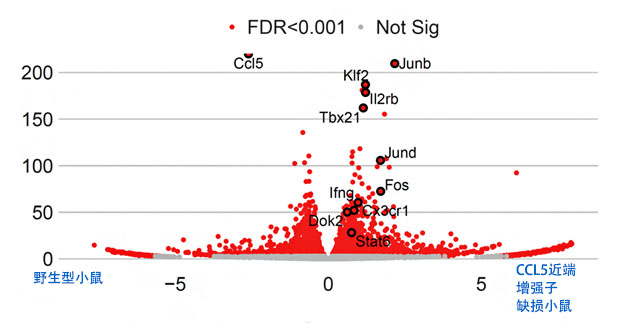
图4:小鼠肺部驻留的自然杀伤细胞的RNA-seq结果
各点表示基因。黑色圆圈圈住的红点表示野生型和CCL5近端增强子缺损细胞中表达量不同的基因。CCL5近端增强子缺损小鼠体内与攻击癌细胞的功能有关的基因表达量更高。横轴表示各基因表达量的差异,纵轴表示表达量的显著差异程度。
未来展望
通过此次研究确认,CCL5是调节免疫细胞功能的重要分子。尤其是随着CCL5的表达降低,癌症免疫反应会增强,因此通过抑制CCL5及其受体CCR5,可实现有效的癌症免疫疗法,有望应用于新的癌症免疫疗法的开发。
论文信息
题目:Runx-mediated regulation of CCL5 via antagonizing two enhancers influences immune cell function and anti-tumor immunity
期刊:《Nature Communications》
DOI:10.1038/s41467-020-15375-w
文:JST客观日本编辑部














