日本九州大学生体防御医学研究所的中山敬一主任教授和医学系学府博士课程4年级的小玉学研究生,与新潟大学研究生院医齿学综合研究科的松本雅记教授等人组成的研究团队,通过采用新一代蛋白质组学技术iMPAQT系统的癌症代谢解析发现,在恶性癌症中,利用来自谷氨酰胺的氮,进行DNA合成的代谢系统亢进(氮转移)。
碳和氮是生物体的主要构成要素,主要由葡萄糖和谷氨酰胺两大营养素提供。大约100年前就已经知道,在癌细胞中,厌氧代谢碳源——葡萄糖的“瓦氏效应”会增强(碳转移)。另一方面,由于癌细胞活跃增殖,需要大量产生含氮DNA,但此前一直不清楚癌细胞是如何从谷氨酰胺向DNA高效分配氮的。
为此研究团队利用自主开发的iMPAQT系统,追踪了代谢酶的表达随着癌细胞恶化而发生的变化,发现恶化的癌细胞中高度表达一种将谷氨酰胺的氮转移至DNA前驱体的代谢酶PPAT,由此判定引起谷氨酰胺氮代谢转移是癌症恶化所必须的步骤。另外,通过对录入公共数据库中的11,000名癌症患者进行元分析(meta-analysis),发现PPAT在全部约1200种人代谢酶中是最能提高癌症患者死亡风险的因子,有望作为治疗小细胞肺癌等难治性癌症的靶标。这些成果表明,对于目前难以治疗的小细胞肺癌等难治性癌症,PPAT抑制剂(目前正在开发中)有望成为有效的治疗方法。
<研究背景与经过>
碳和氮是生物体的主要构成要素(图1)。细胞会吸收葡萄糖(碳源)和谷氨酰胺(氮源)作为必须的营养素。尤其是癌细胞,大约100年前就已经知道,癌细胞对作为碳源的葡萄糖的厌氧性代谢显示出强烈的依赖性,这种现象利用发现者的名字命名,称为瓦氏效应(碳转移)。另一方面,癌细胞对作为氮源的谷氨酰胺也显示出非常强烈的依赖性,但长期以来一直不清楚癌细胞是如何代谢并利用谷氨酰胺的氮的。
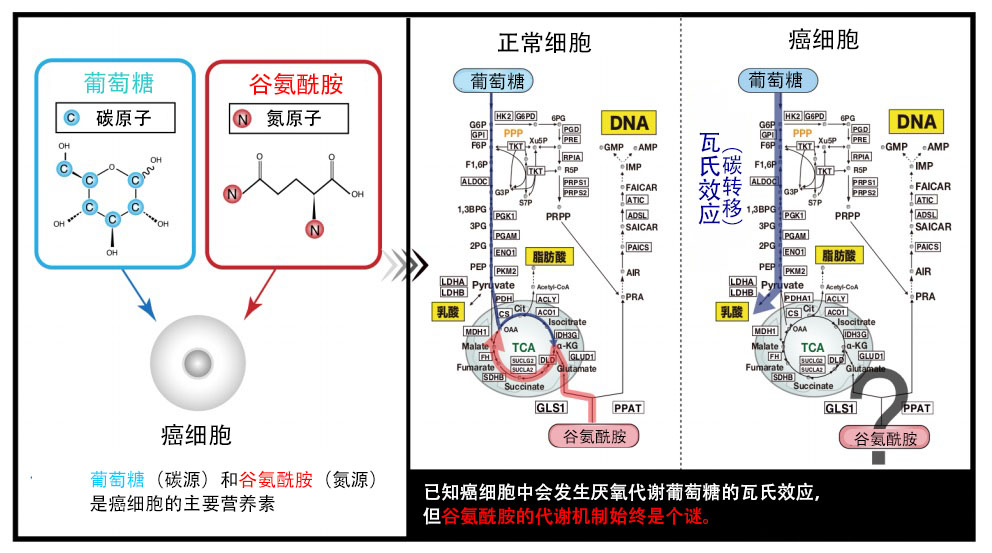
图1:葡萄糖和谷氨酰胺是癌细胞不可或缺的营养素
因此,该研究团队利用自主开发的新一代蛋白质组学技术“iMPAQT系统”,统一测量了癌细胞中表达的所有代谢酶,尝试调查了癌症恶化过程中谷氨酰胺的氮代谢机制(图2)。
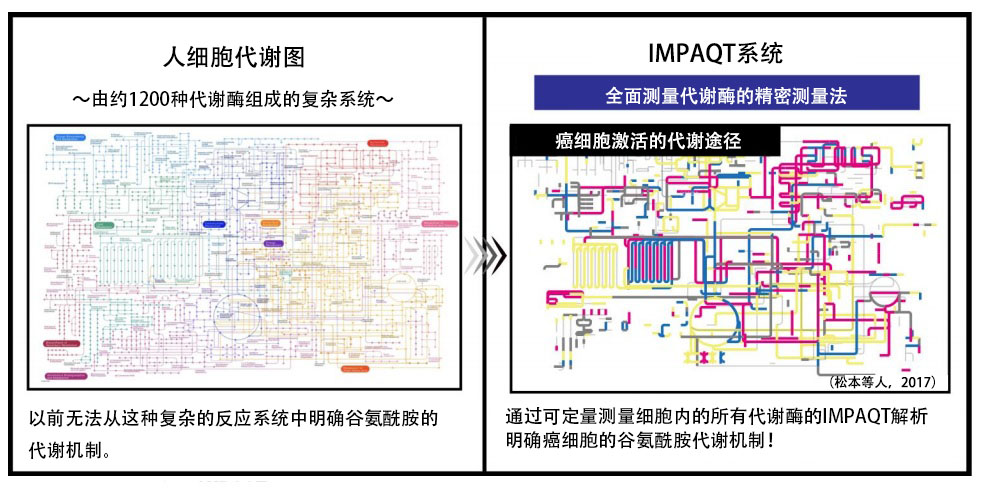
图2:iMPAQT系统可全面解析癌症代谢酶
<研究内容>
该研究团队利用iMPAQT系统,比较解析了癌变初期阶段的前癌细胞和恶化的癌细胞中的代谢酶表达量(图3)。解析发现,在恶化的癌细胞中,糖酵解代谢酶的表达升高,瓦氏效应(碳转移)增强。
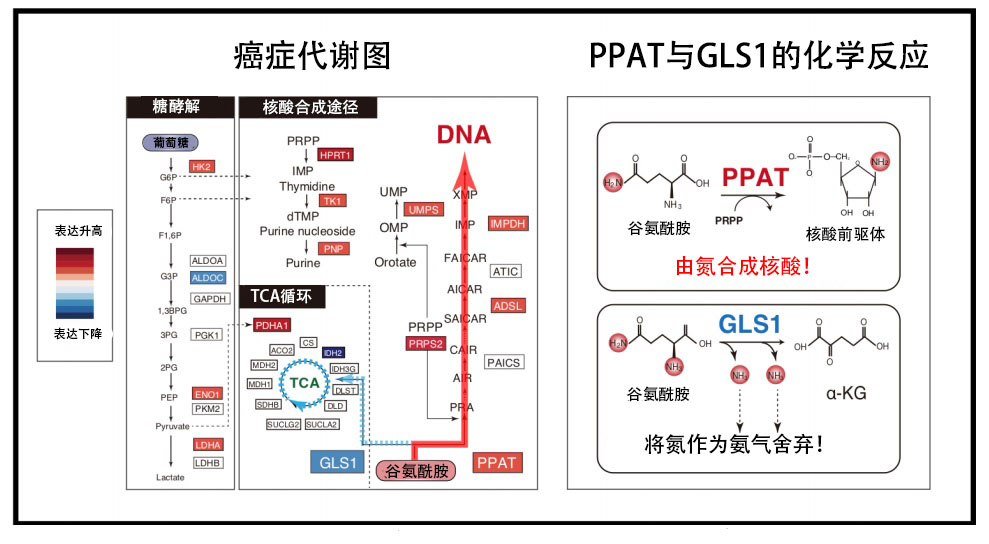
图3:癌症恶化过程中发生谷氨酰胺氮代谢转移
此外,在恶化的癌细胞中,合成DNA的代谢酶群表达升高,其中,将谷氨酰胺的氮转移至核酸前驱体的代谢酶PPAT的表达量显著增加。
相反,负责将谷氨酰胺的氮作为氨排放到体外的代谢酶谷氨酰胺酶(GLS1)的表达量明显下降。这些结果表明,恶化的癌细胞中发生了大规模的氮代谢转移,也就是说,为有效合成增殖所需的DNA,会增强通过PPAT将谷氨酰胺氮转移至DNA前驱体的反应,同时会抑制将谷氨酰胺的氮排放到体外、而非加以利用的GLS1反应(图3)。
接下来,为验证恶化癌细胞中的谷氨酰胺氮代谢转移是否是反映在实际癌症患者的预后中的普遍现象,实施了对公共数据库中录入的11000名癌症患者数据进行综合分析的元分析(meta-analysis,图4)。结果显示,PPAT是大约1200种代谢酶中最能提高癌症患者死亡风险的因子。相反,属于GLS1介导的谷氨酰胺代谢途径的所有代谢酶都是降低死亡风险的因子(图4)。这个结果表明,谷氨酰胺的氮代谢转移是癌症恶化所必须的步骤,而且是普遍现象。
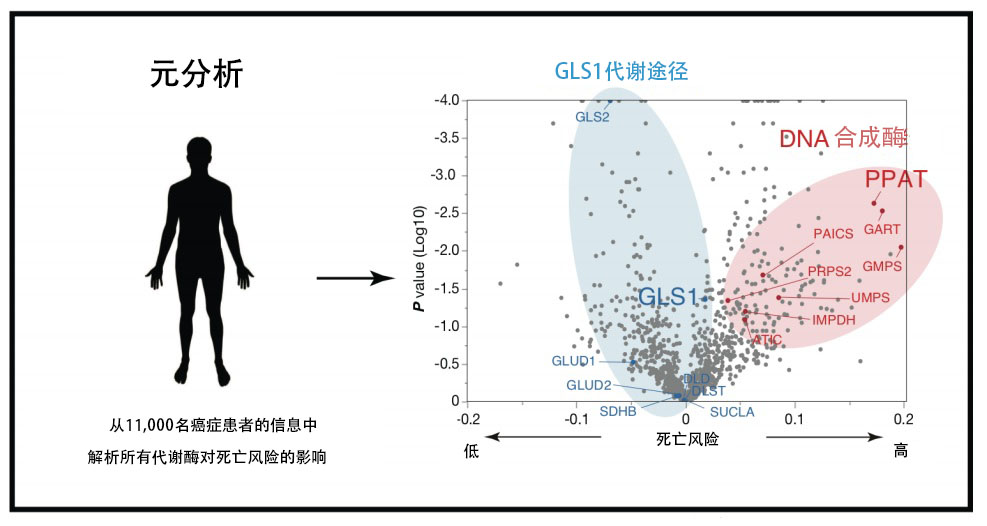
图4:PPAT会提高癌症患者的死亡风险
这种倾向在尚未确立有效疗法的难治性癌症“小细胞肺癌”中最明显。也就是说,在小细胞肺癌患者体内,癌变部位的PPAT表达量比正常组织明显升高(图5)。另外还确认,在小细胞肺癌患者体内,癌变部位的PPAT表达量越高,死亡风险越高(图5)。
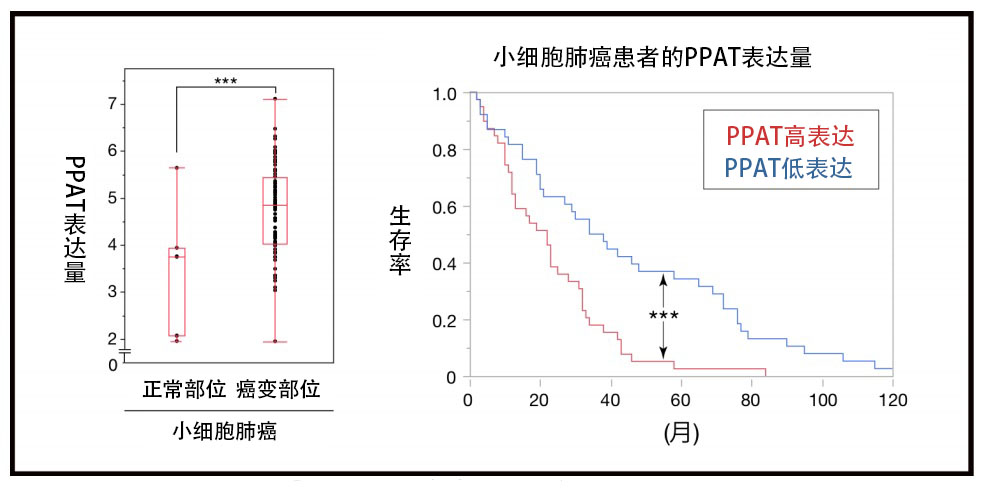
图5:PPAT将成为小细胞肺癌的新治疗靶标
因此,研究团队人为降低了以小细胞肺癌为首的多种癌症的PPAT表达量,发现谷氨酰胺的氮代谢转移被抑制,可以明显抑制这些癌细胞的增殖能力和致瘤性(图6)。从这些结果来看,将来通过使用PPAT抑制剂(目前正在开发中)抑制谷氨酰胺的氮代谢转移,能有效治疗难治性癌症(图7)。
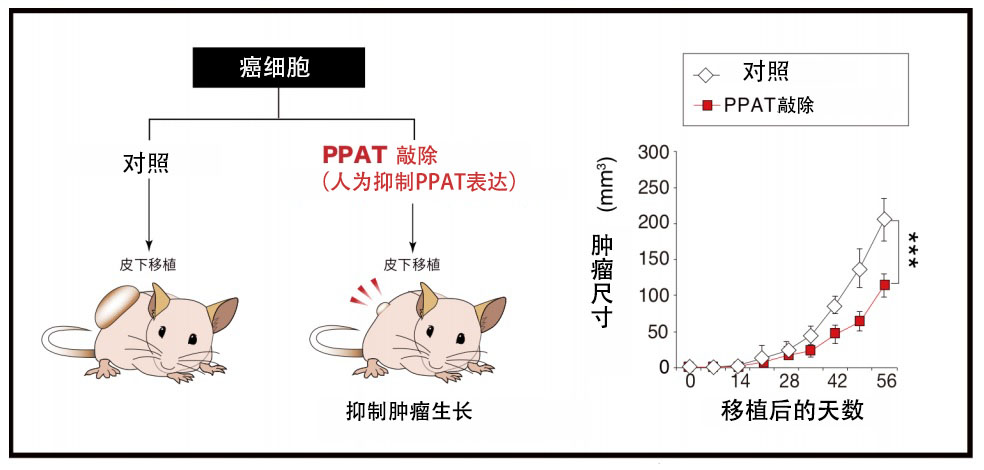
图6:抑制PPAT的表达可以抑制难治性癌症的生长
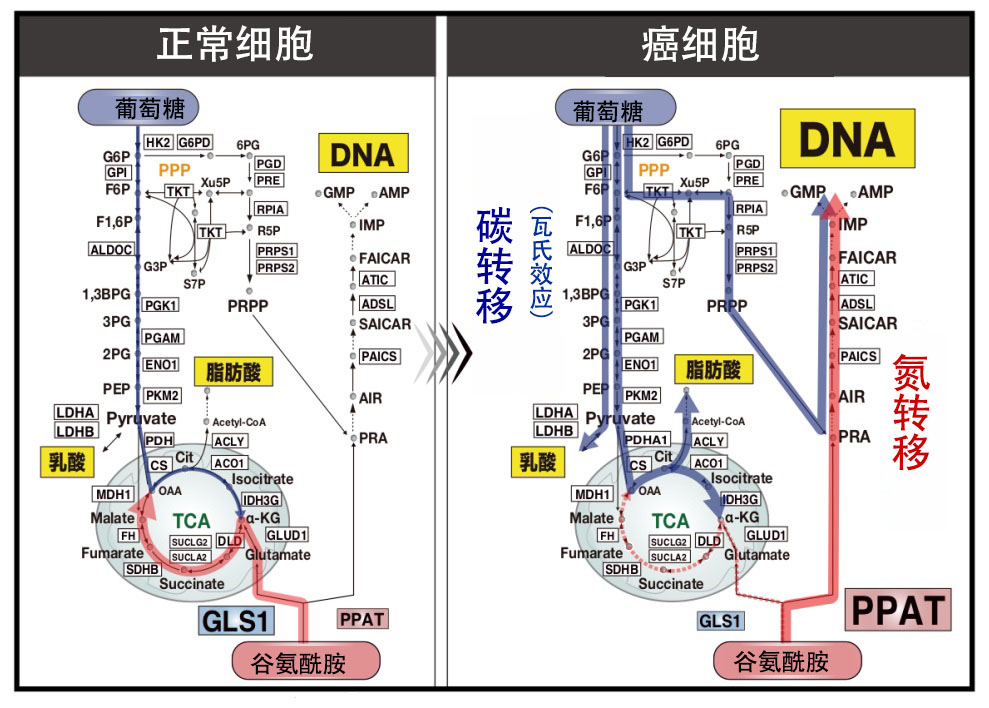
图7:癌症恶化过程中发生的谷氨酰胺氮代谢转移
<未来展望以及用于治疗的期待>
目前,该研究团队正在大规模探索PPAT抑制剂。随着今后开发出PPAT抑制剂,有望针对以小细胞肺癌为代表的难治性癌症确立新的治疗方法。
论文信息
论文题目:A shift in glutamine nitrogen metabolism contributes to the malignant progression of Cancer
期刊:《Nature Communications》
文:JST客观日本编辑部














