3月18日,日本东京大学医科学研究所亚洲传染病研究基地的井上纯一郎教授与山本瑞生助教宣布,发现丝氨酸蛋白酶抑制剂“萘莫司他”(Nafamostat)能够抑制新型冠状病毒(SARS-CoV-2)感染人体细胞的膜融合。这一发现是利用能对病毒进入细胞的最初过程——病毒外膜与细胞膜的融合进行定量评估的膜融合测量系统发现的,丝氨酸蛋白酶抑制剂“萘莫司他”与此前发布的其他融合抑制剂相比,能以1/10以下的低浓度抑制病毒的膜融合。

东京大学于3月18日举行记者会,宣布“萘莫司他”有可能阻止新冠病毒感染人体(照片:共同社)
萘莫司他是日本治疗胰腺炎的处方药物,目前还没有进行针对新型冠状病毒感染症的临床试验。井上纯一郎教授在记者发布会上表示希望能够尽快通过临床实验验证,获得在人体内部也有效的数据。
东京大学教授井上纯一希望能够尽快获得人体有效的结果(照片:NHK报道截屏)
SARS-CoV-2要想感染人体,需要与细胞表面存在的受体蛋白(ACE2受体)结合,然后使病毒外膜与细胞膜融合,这一过程至关重要。就冠状病毒而言,Spike蛋白(S蛋白)与人体细胞膜的ACE2受体结合后,会被蛋白水解酶TMPRSS2切断,激活S蛋白,活化的S蛋白对病毒外膜与细胞膜的融合是十分关键的环节。井上等人根据MERS冠状病毒的研究结果调查了萘莫司他和卡莫司他(Camostat)的作用,发现萘莫司他以1-10nM的低浓度就可以显著抑制病毒侵入。这表明,萘莫司他可能会非常有效地阻止SARS-CoV-2感染。
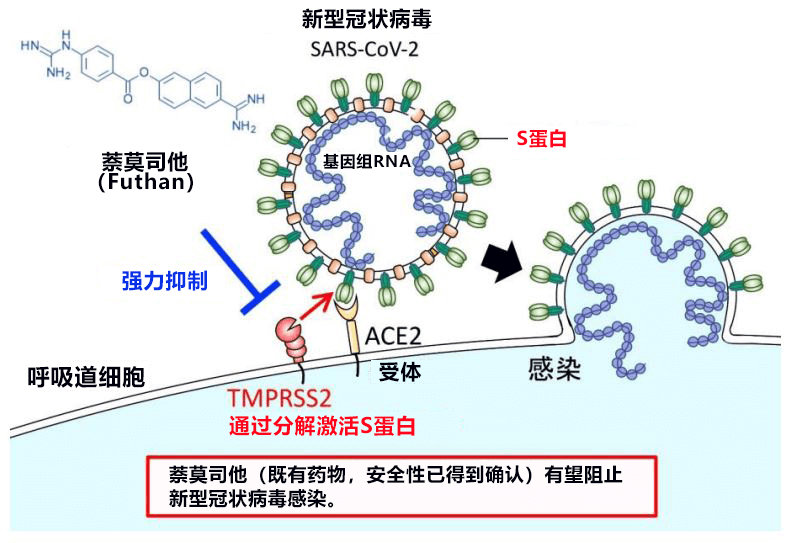
在SARS-CoV-2等冠状病毒中,病毒基因组RNA被由脂质双分子层和外膜蛋白组成的病毒包膜(外膜)包围着。SARS-CoV-2在病毒包膜上的Spike蛋白(S蛋白)与细胞膜受体(ACE2受体)结合后,开始入侵人体细胞。来自人体的细胞蛋白酶(蛋白水解酶)——弗林蛋白酶(Furin)将S蛋白切割为S1和S2。然后,S1与受体ACE2结合。而另一个片段S2被人体细胞表面的丝氨酸蛋白酶TMPRSS2切断,由此出现病毒与细胞的膜融合。
Hoffmann等人发现,呼吸道细胞中有ACE2和TMPRSS2是感染SARS-CoV-2的必备条件(参考文献1)。井上等人在2016年就发现,丝氨酸蛋白酶抑制剂萘莫司他利用依赖MERS-CoVS蛋白、受体CD26和TMPRSS2的膜融合系统能有效抑制膜融合,可作为MERS-CoV感染抑制剂使用(参考文献2)。
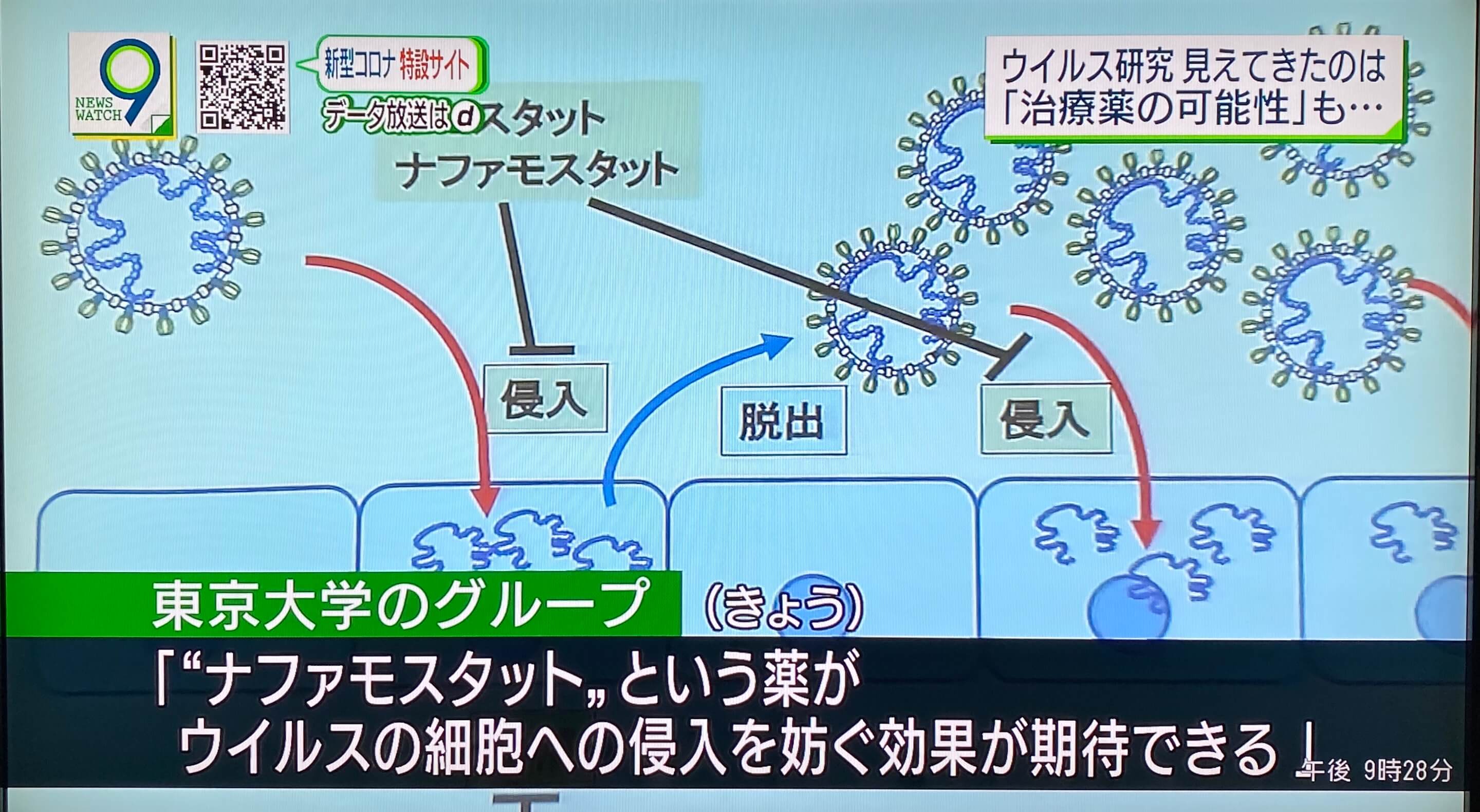
萘莫司他阻止新冠病毒入侵人体细胞的机理图(照片:NHK报道截屏)
此次井上等人利用293FT细胞(源自人类胎儿肾脏)以及依赖SARS-CoV-2S蛋白、受体ACE2和TMPRSS2的膜融合测量系统,研究了萘莫司他能否也抑制SARS-CoV-2S蛋白的膜融合。结果显示,萘莫司他在10至1000nM的浓度范围可以浓度依赖性地抑制膜融合。
接下来井上等人还利用内源性表达ACE2和TMPRSS2、呼吸道上皮细胞源Calu-3细胞(被认为是引起人类感染的重要感染细胞)实施了同样的实验,确认能以更低浓度的1-10nM浓度显著抑制膜融合。这个浓度范围与抑制MERS-CoVS蛋白膜融合的浓度范围基本相同。另外,井上等人还比较了与萘莫司他相似的蛋白水解抑制剂卡莫司他的效果,发现在SARS CoV-2S蛋白的融合中,萘莫司他能够以卡莫司他约1/10的浓度显示出抑制效果。
以上结果表明,在临床使用的蛋白水解抑制剂中,萘莫司他效果最好,有望阻止感染新型冠状病毒感染症。萘莫司他和卡莫司他都是日本治疗胰腺炎的药物,在日本国内已经作为处方药使用多年。萘莫司他在临床上通过静脉注射的方式给药,据推测,给药后的血中浓度将超过此次实验得到的抑制SARS-CoV-2S蛋白膜融合的浓度,所以有望在临床上抑制病毒进入人体细胞。卡莫司他为口服药,服用后的血中浓度被认为会低于萘莫司他,但与其他新型冠状病毒药物合并使用也可能会获得效果。
论文信息
1.Hoffmann et al. Cell 181,1-10(2020)
2.Yamamoto et al. Antimicrob Agents Chemother 60,6532-6539(2016)
文:JST客观日本编辑部














