日本庆应义塾大学理工学部的古川良明副教授和德田荣一助教等人,与同大学药学部的三泽日出巳教授和自然科学研究机构分子科学研究所的秋山修志教授等共同开展研究,指出铜锌离子结合蛋白(铜锌超氧化物歧化酶)SOD1立体结构异常与肌萎缩性侧索硬化症(ALS,简称渐冻症)发病有关的。研究认为,SOD1基因发生突变后,呈异常立体结构的SOD1会在运动神经元中积累,最终引起渐冻症。
虽然目前还不清楚SOD1结构异常是如何触发的,但SOD1氧化过程中一旦解离出铜离子和锌离子后,会变成有毒的异常结构。据报告,很多ALS患者存在氧化应激增加和金属离子动态异常的情况。所以,本次研究的提案对思考与SOD1有关的ALS发病机理也非常重要。
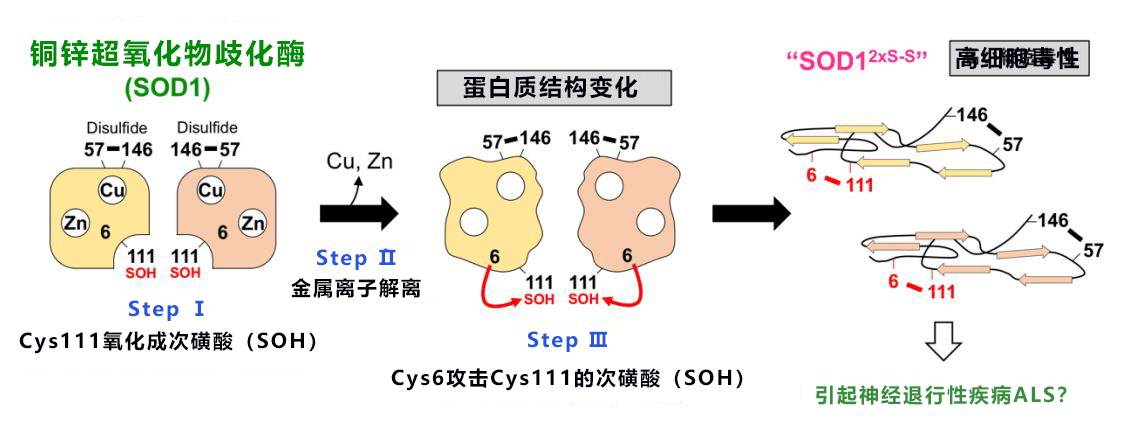
图1:本次研究提出的SOD1错误折叠机制
研究背景
SOD1是结合铜离子和锌离子的金属蛋白,在将高反应性活性氧超氧化物转化为氧分子和过氧化氢方面发挥着重要作用。已知在患难治性神经系统疾病肌萎缩性侧索硬化症(ALS)的部分患者体内,SOD1基因发生突变,错误折叠呈异常立体结构的SOD1会在脊髓的运动神经中积累。另外也在SOD1编码基因未突变的原因不明型散发性ALS患者脑脊液中检测出了高毒性的错误折叠SOD1。也就是说,SOD1的结构异常可能与ALS的发病有关,但具体诱因一直不清楚。
研究内容与成果
研究团队着眼于ALS患者脊髓及其周围的脑脊液中的氧化应激标志物值畸高,且很多生物分子都易被氧化的情况。SOD1产生的过氧化氢发挥了氧化剂的作用,因此研究团队认为SOD1可能随着被氧化而发生了错误折叠。
已知构成蛋白质的氨基酸中,半胱氨酸是最容易被氧化的。SOD1有4个半胱氨酸。在正常结构的SOD1中,Cys57和Cys146两个会被氧化形成“S-S”二硫键,有助于立体结构实现稳定。另外Cys6和Cys111两个半胱氨酸在正常情况下不会被氧化。研究发现,SOD1产生的过氧化氢会使Cys111被氧化成次磺酸状态(图1)。结合的铜离子和锌离子解离后,蛋白质结构会发生巨大变化。通常位于较远位的Cys6会攻击Cys111的次磺酸,在Cys6和Cys111之间形成S-S键(图1)。也就是说,随着氧化应激增加和铜锌离子解离,会形成拥有2个S-S键的异常SOD1(SOD12xS-S)。
研究发现,SOD12xS-S容易聚集形成不溶性沉淀,将其添加到运动神经元样培养细胞NSC-34中显示出了毒性,因此确认其拥有正常的SOD1所不具备的性质。
论文信息
题目:Oxidative misfolding of Cu/Zn-superoxide dismutase triggered by non-canonical intramolecular disulfide formation
期刊:《Free Radical Biology and Medicine》
DOI编号:10.1016/j.freeradbiomed.2019.12.017
中文:JST客观日本编辑部编译














