日本东北大学多元物质科学研究所的镰形清人副教授、高桥聪教授和永次史教授,以及日本产业技术综合研究所人工智能研究中心的主任研究员龟田伦史等人组成的研究团队发现,抑癌蛋白p53会形成液滴状缔合物,并提出了基于液滴状缔合物功能调节的机制。
抑癌蛋白p53通过与靶DNA结合,使细胞周期停滞,修复受损的DNA,并引起细胞凋亡(程序性细胞死亡),从而抑制细胞癌变。此前已知p53会形成四聚体,分散在溶液中发挥功能,但不可逆的聚集会导致其功能丧失。不过,与这种分散状态和固体状聚集物不同,p53在具备液体性质的缔合物中的作用有待查明。
此次,研究团队首先利用微分干涉显微镜和光散射测量,调查了p53是否会形成液滴状缔合物。通过改变pH值和盐浓度等溶液条件进行实验发现,在中性及弱酸性条件下,p53会形成微米尺寸的球形缔合物(Fig. 1a)。另外,多个缔合物接触后会融合形成了一个大的缔合物,从而确认该缔合物具有液体的性质(Fig. 1b)。研究人员认为p53在溶液形成分散相和紧密聚集相属于液-液相分离现象,。
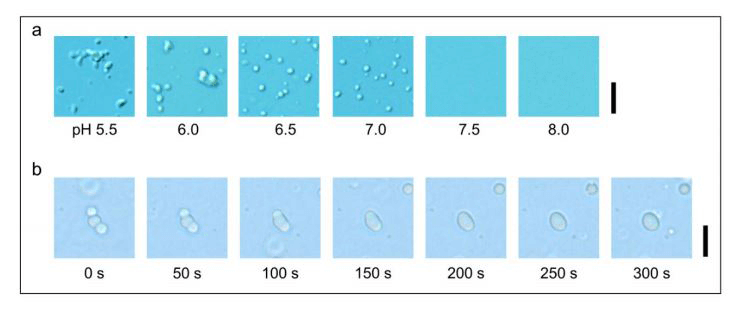
Fig.1:利用微分干涉显微镜观察了p53的液滴状缔合物
接下来,研究团队调查了p53的液滴状缔合物的形成机制。通过对p53部分缺损的突变体进行实验发现,不具备特定立体结构的天然无序区域与液滴形成有关。p53的N末端与C末端的天然无序区域分别携带大量负电荷和正电荷,彼此间应该是通过静电结合的(Fig.2a)。另外,通过测量导入的两种荧光染料之间的荧光共振能量转移确认,p53从分散于溶液中的状态稍微改变立体结构,即可在液滴状缔合物内形成分子间网络(Fig. 2b)。
最后调查了p53的液滴状缔合物与功能调控之间的关系。调查发现,不同于不可逆的聚集物,液滴状缔合物恢复为分散相的p53功能也得以恢复。模拟活体环境的混杂状态,会促进p53液滴状缔合物的形成。此外,通过添加DNA和ATP等生物分子,能抑制p53形成液滴。模拟磷酸化的p53活性化突变体中,液滴的形成也被抑制。以上结果表明,p53的液滴状缔合物可通过各种生物分子和翻译后修饰调控。
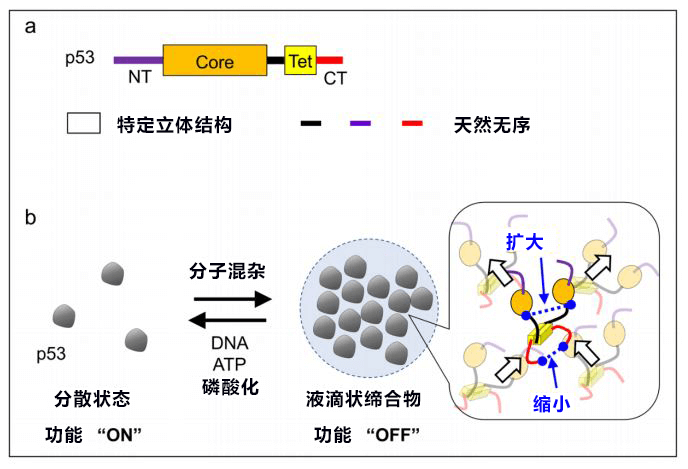
Fig.2:提出通过液滴状缔合物的形成和崩坏启动或关闭p53功能的开关模型
研究团队根据以上结果,提出了与液滴状缔合物有关的功能开关模型(Fig. 2b)。在细胞没有受到压力的普通状态下,p53会形成液滴状缔合物,关闭其功能。当细胞受到压力,p53通过磷酸化等被激活后,就会分散于溶液中,启动其功能。今后,通过验证液滴状缔合物在实际细胞内的形成,有望在分子水平查明p53的抑癌机制。
论文信息
题目:Liquid-like droplet formation by tumor suppressor p53 induced by multivalent electrostatic interactions between two disordered domains
期刊:《Scientific Reports》
DOI:10.1038/s41598-020-57521-w
文:JST客观日本编辑部编译














