日本国立研究开发法人量子科学技术研究开发机构(以下简称“量研”)量子医学医疗部门放射线医学综合研究所先进核医学基础研究部的主任研究员谢琳、研究员破入正行及部长张明荣等人,成功开发出了与癌细胞表面存在的代谢型谷氨酸1型受体(mGluR1)结合,针对恶性黑色素瘤释放α射线的新型靶向同位素治疗候选药物211At-AITM,并通过模型小鼠确认了抑制癌细胞繁殖的效果。
恶性黑色素瘤是一种罕见癌症,在日本每10万人中约有1~2人罹患此病,不仅是皮肤,还会出现在眼球、鼻腔、口腔及食道等粘膜上。如果恶性黑色素瘤仅发生在皮肤和粘膜上,可以通过外科手术切除病变部位及其周围组织进行治疗。
但如果生长在脸部和头颈部,则会严重损害这些部位的功能和姿容,多数情况都难以通过外科手术治疗,而是结合放疗和抗癌药等进行治疗。另外,如果已经转移到淋巴结和其他器官,则需要结合外科手术、放疗和抗癌药等药物疗法进行治疗,但以往的放射疗法难以生效,预后较差,需要开发新的治疗方法。近年来,通过免疫检查点抑制剂和分子靶向药物提高疗效的方法受到期待,但研究发现,这两种方法均有副作用,而且医疗效果也因人而异。
量研的目标是结合从体外照射放射线治疗癌症的重粒子线治疗法,以及利用投入体内的放射性核素释放的放射线治疗癌症的靶向同位素治疗法,同时治疗原发癌(最初发生的癌症)和转移癌,为此一直在推进相关研究开发。在针对头颈部的粘膜恶性黑色素瘤的重粒子线治疗中,难以利用外科手术治疗的病例也取得了良好的治疗效果,目前已被纳入医疗保险。
另一方面,在靶向同位素治疗中,量研利用加速器成功制造了放射性核素211At,放射线的辐射距离为几个细胞那么远,会释放对命中细胞的杀伤力较高的α射线。如果能将211At有效地送到癌细胞中,则有望做到在不损害周围正常组织的情况下,治疗癌症。
因此,作为使211At抵达恶性黑色素瘤的方法,量研着眼于与正常细胞相比,高密度存在于癌细胞表面的蛋白质——代谢型谷氨酸1型受体(mGluR1)。已知mGluR1存在于恶性黑色素瘤和乳腺癌等多种癌细胞的表面,与癌症的形成和生长密切相关。
为此,先进核医学基础研究部从数年前就认为,mGluR1有望成为开发癌症诊断和治疗药物的靶分子,一直在大力开发与mGluR1结合的放射性药物。目前已开发出通过正电子发射断层显像(PET:Positron Emission Tomography)用放射性同位素18F和11C,标记与mGluR1强力结合的多种低分子化合物的诊断用放射性药物。利用这些药物,成功对活体动物的癌细胞实施了PET成像。
本研究利用此前开发与mGluR1结合的化合物,以及开发利用放射性同位素标记该化合物的药物时积累的技术和临床试验经验,新开发了与mGluR1结合释放α射线的新型靶向同位素治疗候选药物211At-AITM(4-211At-astato-N-(4-(6-(isopropylamino)pyridine-4-yl)-1,3-thiazol-2-yl)-N-methylbenzamide)(图1),并利用模型小鼠,评价了针对恶性黑色素瘤的抑癌效果。
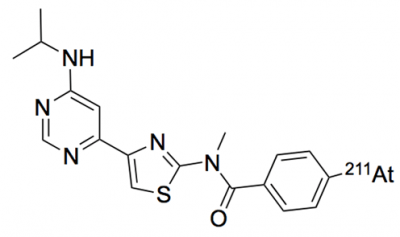
图1:211At-AITM的结构式
研究小组在与高密度存在于恶性黑色素瘤癌细胞表面的mGluR1强力结合的低分子化合物ITM (N-(4-(6-(isopropylamino)pyrimidin-4-yl)-1,3-thiazol-2-yl)-N-methylbenzamide)中添加211At,制作了211At-AITM。
然后向皮下移植了恶性黑色素瘤细胞的模型小鼠静脉注射一次211At-AITM,调查了癌症尺寸的变化。最终确认,分别注射1.11MBq6、1.85MBq和2.96MBq的211At-AITM的群组,与没有注射211At-AITM的群组相比,均显著抑制了癌细胞的繁殖(图2)。
在注射2.96MBq的211At-AITM的群组,还出现了癌症完全消失的小鼠。
另一方面,注射211At-AITM的所有群组均未观察到担心的体重减轻等副作用。
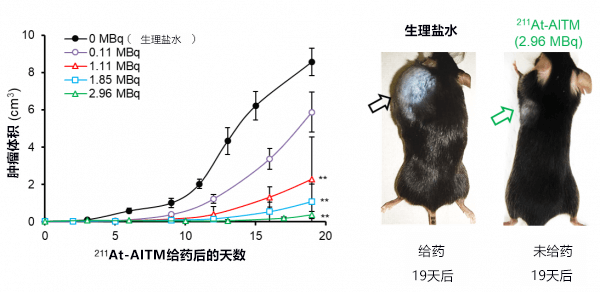
图2:通过注射211At-AITM抑制癌细胞繁殖的效果比较
文:JST客观日本编辑部翻译整理














